Содержание
Аргинин | это… Что такое Аргинин?
Аргинин (2-амино-5-гуанидиновалериановая кислота) — алифатическая основная α-аминокислота. Оптически активна, существует в виде L- и D- изомеров. L-Аргинин входит в состав пептидов и белков, особенно высоко содержание аргинина в основных белках — гистонах и протаминах (до 85%).
Содержание
|
Химические свойства
Цвиттер-ион аргинина
Аргинин является основной аминокислотой, несущей два основных центра: аминогруппу в α-положении и гуанидиновую в δ-положении. Гуанидиновая группа благодаря резонансной делокализации заряда при протонировании является сильно основной (pKa 12.48), находится в протонированной катионной форме при pH < 10 и способна образовывать множественные водородные связи. В слабощелочных и нейтральных растворах аргинин образует цвиттер-ион. Высокая основность аргинина и, соответственно, способность образовывать ионные связи с фосфатными группами ДНК, обуславливает образование нуклеопротеидов — комплексов гистон-ДНК хроматина и протамин-ДНК гетерохроматина сперматозоидов.
В слабощелочных и нейтральных растворах аргинин образует цвиттер-ион. Высокая основность аргинина и, соответственно, способность образовывать ионные связи с фосфатными группами ДНК, обуславливает образование нуклеопротеидов — комплексов гистон-ДНК хроматина и протамин-ДНК гетерохроматина сперматозоидов.
Биологические свойства
Аргинин — условно-незаменимая аминокислота. У взрослого и здорового человека аргинин вырабатывается организмом в достаточном количестве. В то же время, у детей и подростков, у пожилых и больных людей уровень синтеза аргинина часто недостаточен. Биосинтез аргинина осуществляется из цитруллина под действием аргининсукцинатсинтазы и аргининсукцинатлиазы.
Аргинин является одним из ключевых метаболитов в процессах азотистого обмена (орнитиновом цикле млекопитающих и рыб).
Аргинин является субстратом NO-синтаз в синтезе оксида азота NO, являющегося локальным тканевым гормоном с множественными эффектами — от провоспалительного до сосудистых эффектов и стимуляции ангиогенеза.
Содержание в продуктах питания
L-Аргинин встречается во многих продуктах питания, как животного, так и растительного происхождения. В таблице приведены данные по содержанию аргинина на 100 грамм продукта и указано содержание белка.
| Продукт | Белок | Аргинин | А/Б |
|---|---|---|---|
| Свинина сырая | 20,95 г | 1394 мг | 0 6,7% |
| Сырое куриное филе | 21,23 г | 1436 мг | 0 6,8% |
| Сырое филе лосося | 20,42 г | 1221 мг | 0 6,0% |
| Куриное яйцо | 12,57 г | 0 820 мг | 0 6,5% |
| Коровье молоко, 3,7% жирности | 0 3,28 г | 0 119 мг | 0 3,6% |
| Кедровые орехи | 13,69 г | 2413 мг | 17,6% |
| Грецкие орехи | 15,23 г | 2278 мг | 15,0% |
| Тыквенные семечки | 30,23 г | 5353 мг | 17,7% |
| Пшеничная мука г/п | 13,70 г | 0 642 мг | 0 4,7% |
| Кукурузная мука | 0 6,93 г | 0 345 мг | 0 5,0% |
| Рис нешлифованный | 0 7,94 г | 0 602 мг | 0 7,6% |
| Гречишный хлеб | 13,25 г | 0 982 мг | 0 7,4% |
| Горох сушеный | 24,55 г | 2188 мг | 0 8,9% |
Применение
Лекарственные средства
Аргинин присутствует в рецептуре гепатопротекторов, иммуномодуляторов, кардиологических препаратов, лекарственных препаратов для ожоговых больных, больных ВИЧ/СПИД, а также в рецептурах средств для парентерального питания в послеоперационный период.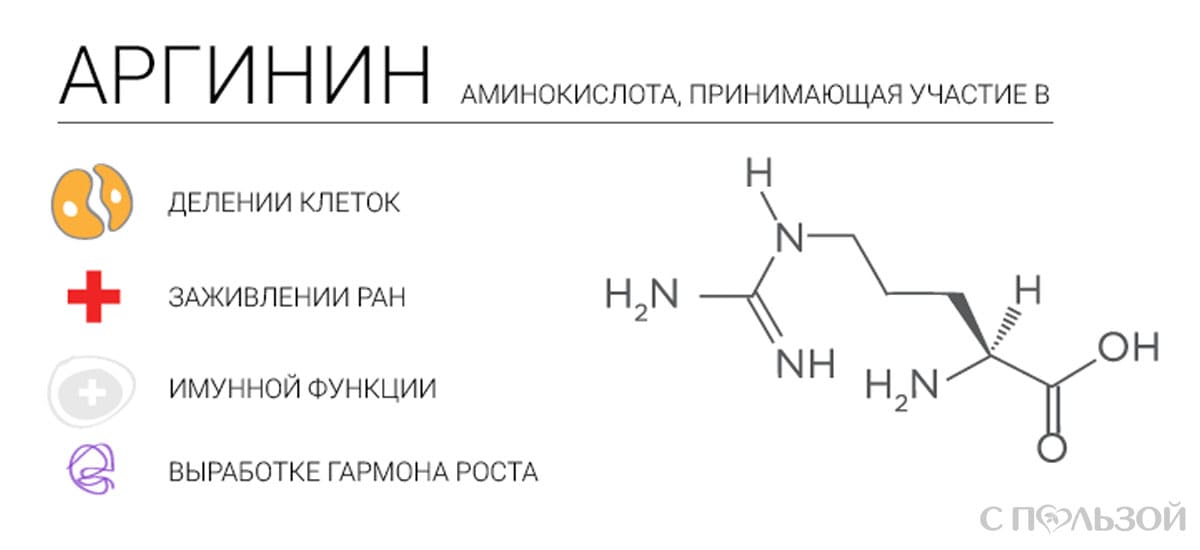 В последнее время лекарства с аргинином появились в геронтологии и онкологии.
В последнее время лекарства с аргинином появились в геронтологии и онкологии.
Проводится тестирование L-аргинина в качестве средства терапии инсультоподобных эпизодов при митохондриальном заболевании — синдроме MELAS.[1][2][3][4]
Пищевые добавки
Аргинин широко рекламируется как компонент БАД для бодибилдеров и спортсменов- тяжёлоатлетов с целью улучшения питания мышц, и пожилых людей для улучшения эректильной функции. Так же массово применяется аргинин и в пищевых добавках, рекламируемых «в целях стимулирования иммунитета». Эффективность аргинина в бодибилдинге опровергнута в нескольких исследованиях.[источник не указан 175 дней] Аргинин является донатором оксида азота, открытие биологических эффектов которого было удостоено Нобелевской премии в медицине.[5]
Примечания
- ↑ Koga Y, Akita Y, Junko N, Yatsuga S, Povalko N, Fukiyama R, Ishii M, Matsuishi T (June 2006).
 «Endothelial dysfunction in MELAS improved by l-arginine supplementation». Neurology 66 (11): 1766–9. DOI:10.1212/01.wnl.0000220197.36849.1e. PMID 16769961.
«Endothelial dysfunction in MELAS improved by l-arginine supplementation». Neurology 66 (11): 1766–9. DOI:10.1212/01.wnl.0000220197.36849.1e. PMID 16769961. - ↑ Koga Y (November 2008). «[L-arginine therapy on MELAS]» (Japanese). Rinsho Shinkeigaku 48 (11): 1010–2. PMID 19198147.
- ↑ Koga Y, Akita Y, Nishioka J, Yatsuga S, Povalko N, Katayama K, Matsuishi T (2007). «MELAS and L-arginine therapy». Mitochondrion 7 (1-2): 133–9. DOI:10.1016/j.mito.2006.11.006. PMID 17276739.
- ↑ Finsterer J (November 2009). «Management of mitochondrial stroke-like-episodes». Eur. J. Neurol. 16 (11): 1178–84. DOI:10.1111/j.1468-1331.2009.02789.x. PMID 19780807.
- ↑ Аргинин в медицине
структурная формула и реакции биосинтеза
Аргинин – условно незаменимая аминокислота. В принципе, аргинин синтезируется в организме человека, поэтому его нельзя отнести к полностью незаменимым питательным веществам, но потребность в нем намного больше, чем может дать собственное производство, особенно в детском возрасте, поэтому он обязательно должен поступать в достаточном количестве с продуктами питания.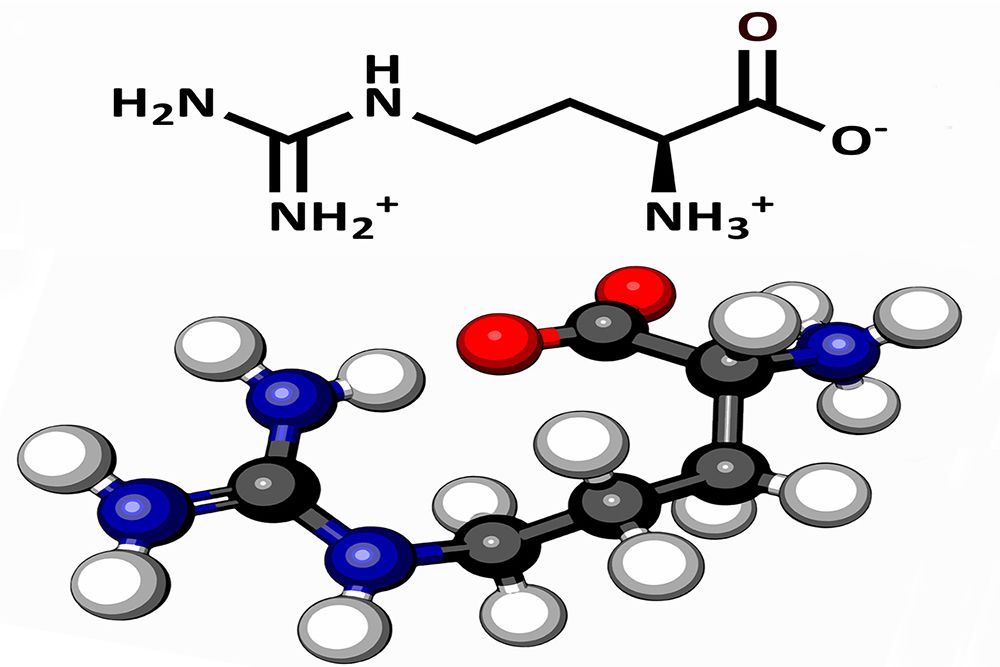 Для детей аргинин считается незаменимой аминокислотой.
Для детей аргинин считается незаменимой аминокислотой.
Вместе с меньшим братом лизином, аргинин относится к группе диаминомонокарбоновых аминокислот, т.е. он имеет две аминных головы по обе стороны углеродного скелета, дополнительно аминная группа NH пристроилась к конечному атому углерода, и еще одна молекула азота разрывает углеродный скелет после четвертого атома углерода, т.е. аргинин имеет в своем составе не одну молекулу азота, как большинство аминокислот, не две, как меньшой брат лизин, а целых четыре. Это имеет большое значение для работы в организме. Аргинин – аминокислота, обладающая основными свойствами, рН – 9,7-10, 7.
Структурная формула аргинина
L-аргинин | D-аргинин |
В зависимости от положения аминной головы относительно углеродного скелета, аминокислота аргинин может иметь различные конфигурации (изомеры), которые условно называют «левые» — L и «правые» — D, ибо они относятся друг к другу как левая и правая рука. В организме могут работать только левые L- изомеры аминокислот. При химическом синтезе образуется равное количество как L, так и D- изомеров, конечный продукт требует дополнительной очистки от балласта, а это дополнительные затраты. Чем чище аминокислота, тем дороже она стоит.
В организме могут работать только левые L- изомеры аминокислот. При химическом синтезе образуется равное количество как L, так и D- изомеров, конечный продукт требует дополнительной очистки от балласта, а это дополнительные затраты. Чем чище аминокислота, тем дороже она стоит.
Биологическая потребность
Суточная потребность в аргинине составляет: для детей – 4 г., для взрослых – 5-6 г.
Биосинтез аргинина
Аргинин синтезируется в организме человека в процессе обезвреживания аммиака. Аммиак NH3 постоянно образуется при мышечной работе в процессе превращения аминокислот в сахара. Это ядовитое соединение, и чтобы не произошло отравления клеток, его необходимо превратить в безопасные вещества. Одним из путей связывания аммиака является синтез мочевины, который происходит в печени, единственном органе, который содержит аргиназу – фермент, расщепляющий аргинин.
Процесс синтеза мочевины, побочным продуктом которого является аргинин, известен как орнитиновый цикл Кребса – Гензелейта. Реакции орнитинового цикла происходят в митохондриях и цитоплазме клеток печени.
Реакции орнитинового цикла происходят в митохондриях и цитоплазме клеток печени.
В митохондриях печени аммиак соединяется с углекислым газом и водой под воздействием фермента карбамоилфосфатсинтетазы в присутствии ионов Магния и используя энергию двух молекул АТФ.
Образуется вещество карбамоилфосфат.
Затем аминогруппа с карбамоилфосфата переносится на аминокислоту орнитин, в результате чего получается аминокислота цитруллин.
Цитруллин выходит из митохондрий в цитоплазму клеток печени, где происходят дальнейшие превращения: он соединяется с аспартатом (аспарагиновой кислотой) образуя аргининосукцинат, иначе говоря, аргининоянтарную кислоту.
Наконец, аргининосукцинат расщепляется на фумарат и аргинин.
Вот и образовался аргинин. Но в печени под воздействием фермента аргиназы в присутствии ионов Кальция и Магния аргинин распадается с образованием мочевины и аминокислоты орнитина.
Орнитин вновь вступает в реакцию с карбамоилфосфатом, и цикл крутится дальше.
Аммиак поставляется в печень с кровью по воротной вене, но может образовываться в митохондриях при отщеплении аминной головы глутаминовой кислоты, которая является основным переносчиком аминных групп по организму.
Полный набор ферментов орнитинового цикла есть только в клетках печени, но в почках есть ферменты, образующие и расщепляющие аргинино-янтарную кислоту, т.е. в клетках почек тоже может образовываться аргинин из цитруллина. Аргинин из почек поступает в разные органы и ткани организма человека, в том числе в печень, где расщепляется с образованием мочевины.
Аргинин является предшественником для синтеза пролина – аминокислоты, образующей коллаген, и глутаминовой кислоты – основного интегратора аминных групп в организме человека. Справедливо и обратное положение: глутаминовая кислота (глутамат) является предшественником орнитина, а тот, в свою очередь, необходим для синтеза аргинина.
О функциях аргинина читайте в продолжении. http://zaryad-zhizni.ru/vliyanie-arginina-na-organizm/
[Аргинин]
Общедоступный
Опубликовано
2017
- EintragstypEntry Type
- Chemical Compound
- EintragsspracheEntry Language
- EnglischEnglish
- SchlagwortKeyword
- Химическое соединение; Аргинин
- ИнЧИ
- ИнЧИ=1S/C6h24N4O2/c7-4(5(11)12)2-1-3-10-6(8)9/h5H,1-3,7h3,(H,11,12 )(h5,8,9,10)/t4-/m0/s1; ODKSFYDXXFIFQN-BYPYZUCNSA-N
кислота
L-(+)-аргинин
Арг
(S)-2-амино-5-гуанидинопентановая кислота
ИД 6322
Аргинин
Источник: Национальный центр биотехнологической информации.
База данных соединений PubChem; CID=6322, https://pubchem.ncbi.nlm.nih.gov/compound/6322
Дополнительную информацию см. на сайте PubChem Compound.
База данных
Найти в базе данных IUPAC
Выпуск 93/2021
149 Синтазы оксида азота
(Noss)/моноксид азота/оксид азота (Ii)/оксидазот
Выпуск 90/2018
Инженерные наноматериалы и
Здоровье человека: Часть 1. Подготовка, функционализация и характеристика
(Технический отчет ИЮПАК)
Выпуск 88/2016
гипофиз
Выпуск 87/2015
гипофиз
Сокращения
(нейротоксикология)
Выпуск 86/2014
Структурные аспекты
Молекулярное распознавание в иммунной системе. Часть II: Распознавание образов
Часть II: Распознавание образов
РецепторыПрименение
Иммунохимия в здоровье человека: достижения в области вакцинологии и антител
Дизайн
Выпуск 83/2011
Практические аспекты
Выпуск 74/2002
Потенциометрическая селективность
Коэффициенты ионоселективных электродов Часть III. Органические ионы
Выпуск 72/2000
Имена для неорганических
РадикалыСвойства и единицы в
Клинические лабораторные науки. Часть X. Свойства и единицы в целом
Часть X. Свойства и единицы в целом
Клиническая химия
Выпуск 70/1998
Отчет о пестицидах 40: связанный
Ксенобиотик в пищевых продуктах растительного и животного происхождения
Выпуск 69/1997
Аминокислотный остаток (в
Полипептид)Расслабляющий эндотелий
Фактор (EDRF)
Выпуск 68/1996
Константы устойчивости металла
Комплексы аминокислот с заряженными боковыми цепями — часть I: положительно
Заряженные боковые цепиАргинин
(2-амино-5-гуанидинопентановая кислота, h3l)Лизин (2,6-диаминогексановая
Кислота, h3l)Орнитин
(2,5-диаминопентановая кислота, h3l)Термодинамические параметры
Протон и металлокомплексы
Выпуск 64/1992
Гистоны
Настоящий и будущий статус
Органические аналитические реагенты — Часть IV. Органические аналитические реагенты в
Органические аналитические реагенты в
Атомно-абсорбционная спектрофотометрия металлов
Выпуск 56/1984
Первичные алкил- и N-амино
Кислоты (колориметрия)Первичные алкил- и
Ариламины и N-аминокислоты (флуориметрия)Аминокислота
НоменклатураНоменклатура пептидов
Три буквы
СистемаОднобуквенная система
Выпуск 54/1982
Смешанные комплексы
Выпуск 51/1979
Типичный анализ пилота
Растительные образцы SCP, полученные из метанола
Выпуск 40/1974
Символы для аминокислот
Производные и пептиды (Правила утверждены в 1974 г. )
)
Выпуск 11/1965
Номенклатура органических
Химия (Окончательные правила для раздела C. Группы характеристик
Содержит углерод, водород, кислород, азот, галоген, серу, селен,
и/или теллур)Карбоновые кислоты и их
Производные
Выпуск 1/1960
Константы диссоциации
Органические кислоты в водном растворе
QuelleSource
- Название
- Химические соединения
- VerlagPublisher
- 2016
Запись в базе данных
[Аргинин]
- МДА
- АПА
- Гарвард
- Чикаго
- Ванкувер
Скопировано в буфер обмена
Дополнительные материалы
Пожалуйста, войдите или зарегистрируйтесь в De Gruyter, чтобы заказать этот продукт.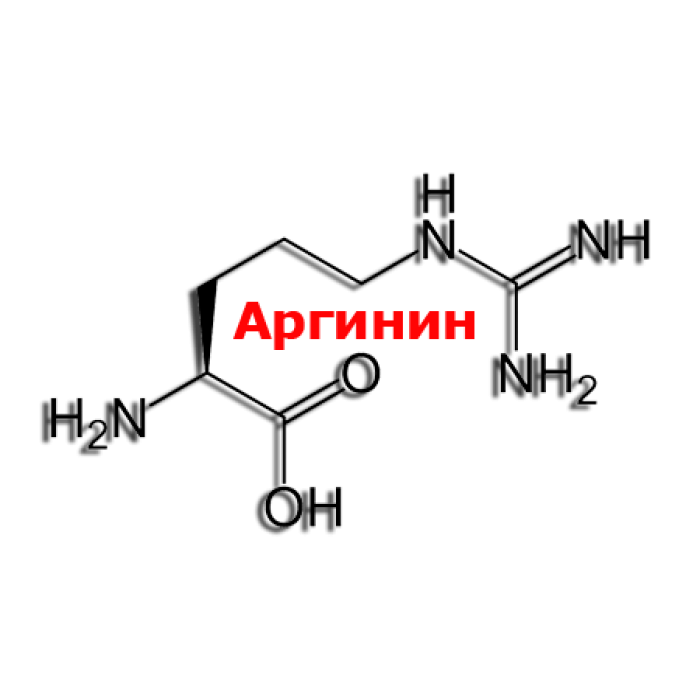
ВойтиРегистрация
Аргинин — Американское химическое общество
- Вы здесь:
СКУД
Молекула недели
Молекула недели Архив
Архив — А
- L-аргинин
Архив молекулы недели
Это была одна из двух молекул на этой неделе
25 сентября 2017 г.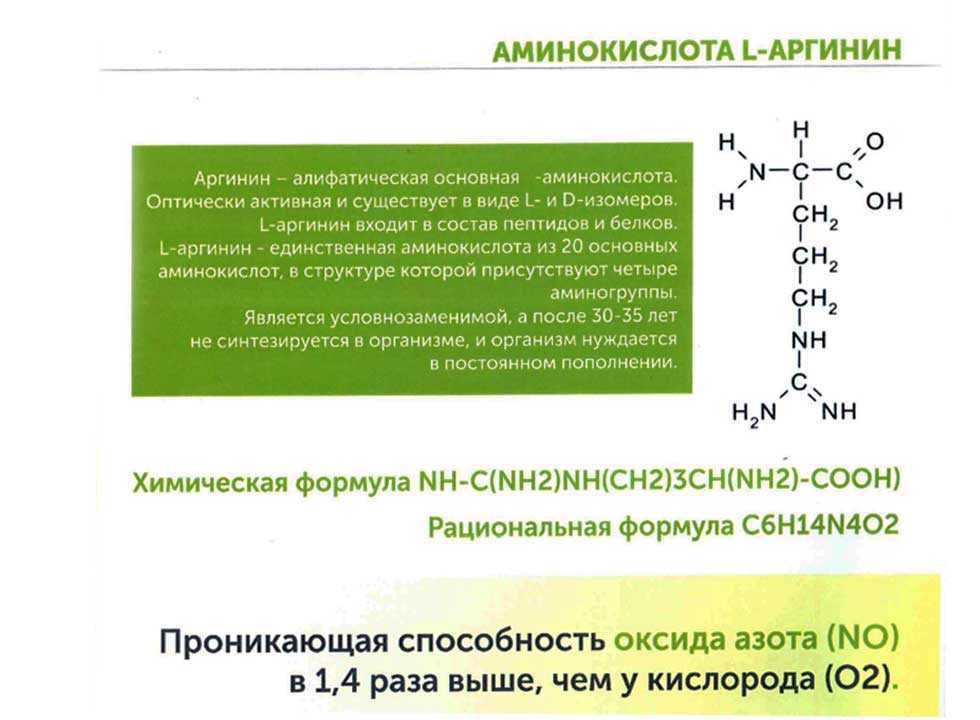
Предыдущий
Далее
Мы, две аминокислоты, можем изменить ситуацию.
Какие мы молекулы?
Рисунок 1: L -Глютамин
Рисунок 2: L -Аргинин
L -Глутамин и L -аргинин классифицируются как полузаменимые или условно незаменимые аминокислоты, что означает, что человеческий организм может синтезировать их при одних состояниях здоровья, но не при других. И того и другого в изобилии во многих продуктах.
Ни D -глутамин или D -аргинин широко распространены в природе, поэтому L-аминокислоты обычно обозначаются без префиксов. В 1883 году немецкие химики Эрнст. Шульце и Э. Босхард выделили L-глютамин из сока сахарной свеклы. Это наиболее распространенная аминокислота в крови человека и ключевой компонент белков.
В 1886 году Шульце также первым выделил L -аргинин, в данном случае из проростков люпина. Это также важная аминокислота в биосинтезе белка.
Оказывается, разница в встречаемости этих двух аминокислот имеет огромное значение для огромных животных. В этом году при изучении меланокортиновой системы* китообразных Роджер Д. Коун из Мичиганского университета (Анн-Арбор) и его коллеги обнаружили, что два подотряда морских млекопитающих имеют разные компоненты в положении 156 рецептора меланокортина-4. Глютамин находится в этом положении у усатых китов, тогда как у зубатых китов и дельфинов вместо него содержится аргинин.
Группа Коуна обнаружила, что аргинин в рецепторе подавляет аппетит животных по сравнению с рецептором, содержащим глютамин. Они считают, что эта разница способствует гораздо большим размерам усатых китов.
*Меланокортиновая система является важным регулятором метаболизма, потребления пищи и накопления жира.
L — Глютамин Краткие факты
CAS Reg. № № | 56-85-9 |
| Молярная масса | 146,14 г/моль |
| Формула | С 5 Н 10 Н 2 О 3 |
| Внешний вид | Белые кристаллы или порошок |
| Температура плавления | 185 ºC (разл.) |
| Растворимость в воде | 25 г/л |
L — Аргинин Краткие факты
| CAS Рег. № | 74-79-3 |
| Молярная масса | 174,20 г/моль |
| Формула | С 6 Н 14 Н 4 О 2 |
| Внешний вид | Белые кристаллы или порошок |
| Температура плавления | 244 ºC (разл.) |
| Растворимость в воде | 15 г/л |
Узнайте больше об этой молекуле из CAS, самого авторитетного и всеобъемлющего источника химической информации.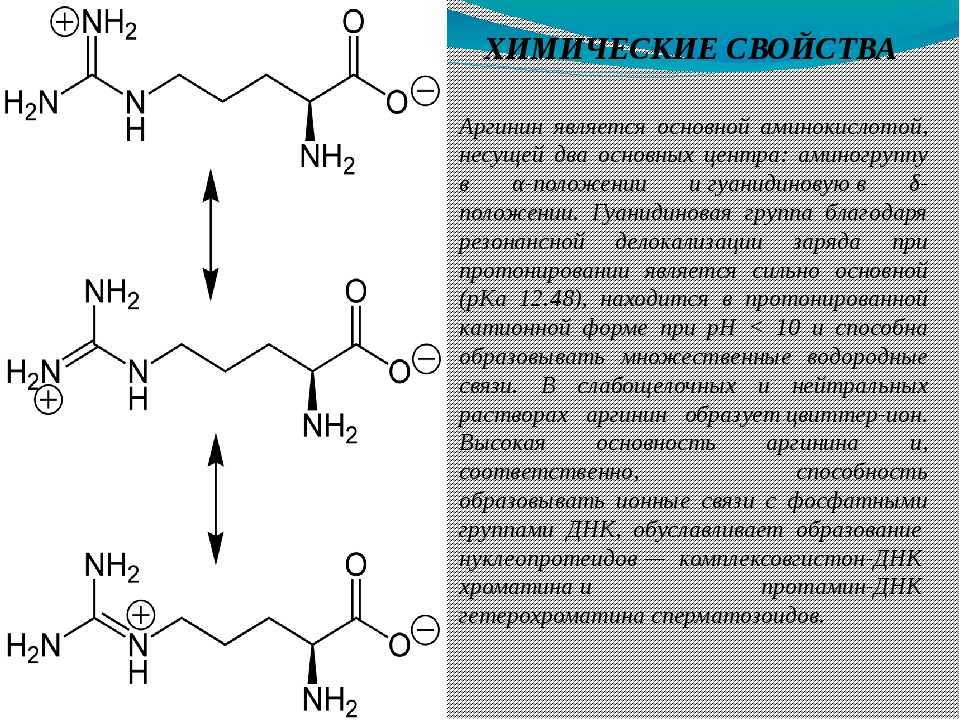
 «Endothelial dysfunction in MELAS improved by l-arginine supplementation». Neurology 66 (11): 1766–9. DOI:10.1212/01.wnl.0000220197.36849.1e. PMID 16769961.
«Endothelial dysfunction in MELAS improved by l-arginine supplementation». Neurology 66 (11): 1766–9. DOI:10.1212/01.wnl.0000220197.36849.1e. PMID 16769961. Часть II: Распознавание образов
Часть II: Распознавание образов Часть X. Свойства и единицы в целом
Часть X. Свойства и единицы в целом Органические аналитические реагенты в
Органические аналитические реагенты в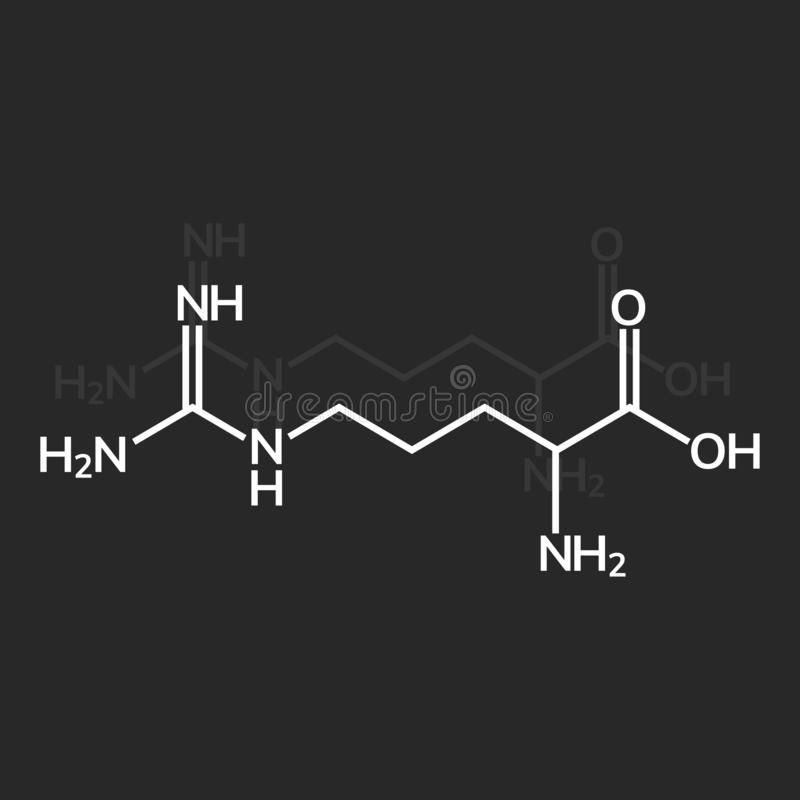 )
)