Содержание
Сахароза. Физические и химические свойства
Похожие презентации:
Сахароза
Аминокислоты. Физические свойства. Химические свойства
Углеводы: классификация, строение и физико-химические свойства
Аминокислоты. Химические и физические свойства
Исследование физико-химических свойств растворов сахарозы
Химический состав и физические свойства продовольственных товаров
Галогены. Химические свойства
Химические свойства легкоплавких металлов
Литий. Физические и химические свойства
Поливинилхлорид. Физические и химические свойства
Работа студентов:
Матвей Пичуев
Матвей Ромащенко
Александр Смирнов
Даниил Луппов
Руслан Кабиров
Сахароза
Структурная формула сахарозы
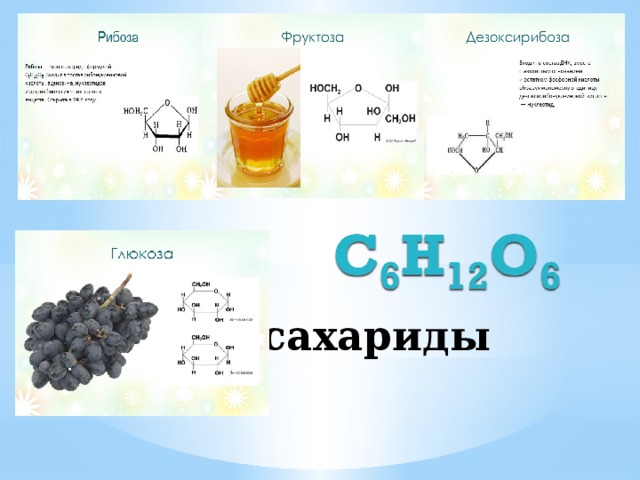
• Сахаро́за (сукро́за, тростниковый сахар) C12h32O11, в быту
просто сахар, — дисахарид из группы олигосахаридов, состоящий из
двух моносахаридов: α-глюкозы и β-фруктозы.
• Сахароза является весьма распространённым в природе
дисахаридом. Она встречается во многих фруктах, плодах и ягодах.
Она встречается во многих фруктах, плодах и ягодах.
Особенно велико содержание сахарозы в сахарной свёкле и сахарном
тростнике, которые и используются для промышленного производства
пищевого сахара.
• Сахароза, попадая в кишечник, быстро гидролизуется альфаглюкозидазой тонкой кишки на глюкозу и фруктозу, которые затем
всасываются в кровь. Ингибиторы альфа-глюкозидазы, такие,
как акарбоза, тормозят расщепление и всасывание сахарозы, а также
и других углеводов, гидролизуемых альфа-глюкозидазой, в
частности крахмала. Это используется в лечении сахарного диабета
2-го типа[2].
Физические свойства
• В чистом виде — бесцветные моноклинные кристаллы. При
застывании расплавленной сахарозы образуется аморфная
прозрачная масса — карамель. Сахароза имеет высокую
растворимость. Растворимость (в граммах на 100 граммов
растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле
0,9 (20 °C). Малорастворима в метаноле. Не растворима
в диэтиловом эфире. Плотность 1,5879 г/см3 (15 °C).
Плотность 1,5879 г/см3 (15 °C).
Удельное вращение для D-линии натрия: 66,53 (вода; 35
г/100г; 20 °C). Температура плавления 186℃.
Химические свойства
• В чистом виде — бесцветные моноклинные кристаллы. При
застывании расплавленной сахарозы образуется аморфная
прозрачная масса — карамель. Сахароза имеет высокую
растворимость. Растворимость (в граммах на 100 граммов
растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле
0,9 (20 °C). Малорастворима в метаноле. Не растворима
в диэтиловом эфире. Плотность 1,5879 г/см3 (15 °C).
Удельное вращение для D-линии натрия: 66,53 (вода; 35
г/100г; 20 °C). Температура плавления 186℃.
Реакция с водой
• Если прокипятить раствор сахарозы с несколькими каплями
соляной или серной кислоты и нейтрализовать кислоту
щелочью, а после этого нагреть раствор, то появляются
молекулы с альдегидными группами, которые и
восстанавливают гидроксид меди(II) до оксида меди(I). Эта
реакция показывает, что сахароза при каталитическом
действии кислоты подвергается гидролизу, в результате
чего образуются глюкоза и фруктоза:
C12h32O11+h3O C6h22O2+C6h22O6
Природные и антропогенные источники
• одержится в сахарном тростнике, сахарной свёкле (до 28 %
сухого вещества), соках растений и плодах (например, берёзы,
клёна, дыни и моркови).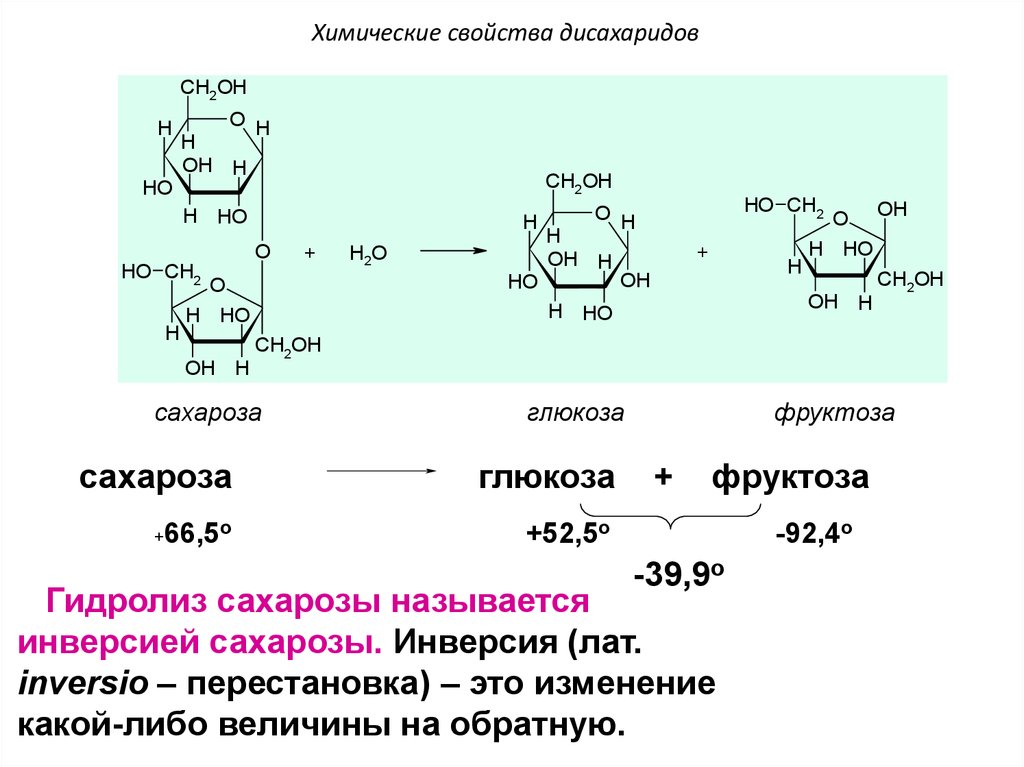 Источник получения сахарозы — из
Источник получения сахарозы — из
свёклы или из тростника, определяют по соотношению
содержания стабильных изотопов углерода 12C и 13C. Сахарная
свёкла имеет C3-механизм усвоения углекислого газа
(через фосфоглицериновую кислоту) и предпочтительно
поглощает изотоп 12C; сахарный тростник имеет C4-механизм
поглощения углекислого газа (через щавелевоуксусную кислоту)
и предпочтительно поглощает изотоп 13C.
• Мировое производство в 1990 году — 110 000 000 тонн.
Кристаллы коричневого (нерафинированного
тростинокового) сахара
Статичное 3D-Изображение молекулы
сахарозы
Физические свойста»2
Состояние
Твёрдое, кристаллическое
Молярная масса
342,2965 ± 0,0144 г/моль
Плотность
1,587 г/см³
Термические свойста
Температура
• плавления
186 °C
• разложения
367 ± 1 ℉ и 320 ± 1 ℉
Давление пара
0 ± 1 мм рт.ст.
[1]
[1]
[1]
Получение
• Сахароза – наиболее распространённый в природе углевод.
Соединение входит в состав фруктов, ягод, листьев растений. Большое
количество готового вещества содержится в свёкле и сахарном
тростнике. Поэтому сахарозу не синтезируют, а выделяют с помощью
физического воздействия, вываривания и очищения.
Получение»2
• Свёклу или сахарный тростник мелко натирают и помещают в
большие котлы с горячей водой. Сахароза вымывается, образуя
сахарный раствор. В нём присутствуют различные примеси –
красящие пигменты, белки, кислоты. Чтобы отделить сахарозу, в
раствор добавляют гидроксид кальция Ca(OH)2. В результате
образуется осадок и сахарат кальция С12Н22О11·CaO·2Н2О, через
который пропускают диоксид углерода (углекислый газ). В осадок
выпадает карбонат кальция, а оставшийся раствор выпаривают
до образования кристалликов сахара.
English
Русский
Правила
нахождение в природе, строение молекулы, изомерия, физические свойства и химические свойства, получение. Общие представления об олигосахаридах».
 10 класс
10 класс
10
класс. Дата
Урок №25 . План-конспект по теме: «Углеводы. Глюкоза: нахождение в природе, строение
молекулы, изомерия, физические свойства и химические свойства, получение.
Общие представления об олигосахаридах».
Цель урока:
дать представление об углеводах на примере глюкозы; познакомить обучающихся с
составом и строением молекулы глюкозы, её физическими свойствами, значением в
природе, научить определять химические свойства органических соединений, исходя
из их строения и наличия соответствующих функциональных групп на примере
глюкозы как альдегидоспирта; раскрыть общие представления об олигосахаридах на
примере сахарозы.
Оборудование
и материалы: Таблица
«Классификация углеводов», штатив с пробирками, пробиркодержатель, спиртовка, раствор
глюкозы, сахарозы, растворы сульфата меди (II), гидроксида
натрия, презентация по данной теме.
Тип
урока: изучение
нового материала.
Методы
обучения: словесные,
пояснительно-иллюстративные, практические: проведение лабораторного
эксперимента, репродуктивные; частично поисковые, интерактивные.
Задачи урока: Обучающие:
• Закрепить понятия «углеводы»,
«альдегидоспирт», «альдегидная форма глюкозы»,
«циклическая α-
и β-
формы»; закрепить навыки обучающихся составлять
уравнения реакций получения и свойства глюкозы и сахарозы;
• закрепить навыки
составлять структурные формулы α- и β- формы глюкозы;
• научить прогнозировать химические
свойства органических соединений, исходя из их строения и наличия
соответствующих функциональных групп на примере глюкозы как альдегидоспирта.
Развивающие:
• Продолжить применять
компетентностный подход при изучении строения и
свойств углеводов на примере глюкозы и сахарозы; познакомить обучающихся с
качественными реакциями на глюкозу и сахарозу; развивать логическое мышление, умения
наблюдать, анализировать и сравнивать, находить причинно-следственные связи,
делать выводы, формировать заинтересованность предметом.
Воспитательные:
• Формировать экологическую
сознательность обучающихся при
рассмотрении пищевой ценности глюкозы; познакомить обучающихся с
распространением углеводов в природе, их биологической ролью, применением; формировать научное мировоззрение обучающихся;
совершенствовать трудовые навыки;
• научить
обучающихся расширять свои знания об органических кислородсодержащих веществах
на примере углеводов, их свойствах; научить
слышать учителя и своих одноклассников, быть внимательным к себе и окружающим,
оценивать себя и других, вести беседу.
Структура урока:
I.
Организационный
этап.
1 мин
II.
Проверка домашнего
задания. 5
мин
III.
Актуализация опорных знаний. Мотивация учебной деятельности. 5 мин
IV.
Изучение нового материала. 23
мин
1.
Понятие об углеводах;
2.
Строение молекулы, свойства и получение глюкозы;
3.
Применение глюкозы;
4.
Представления об олигосахаридах.
V.
Первичное применение полученных знаний. 6
мин
VI.
Домашнее задание. 2
мин
VII.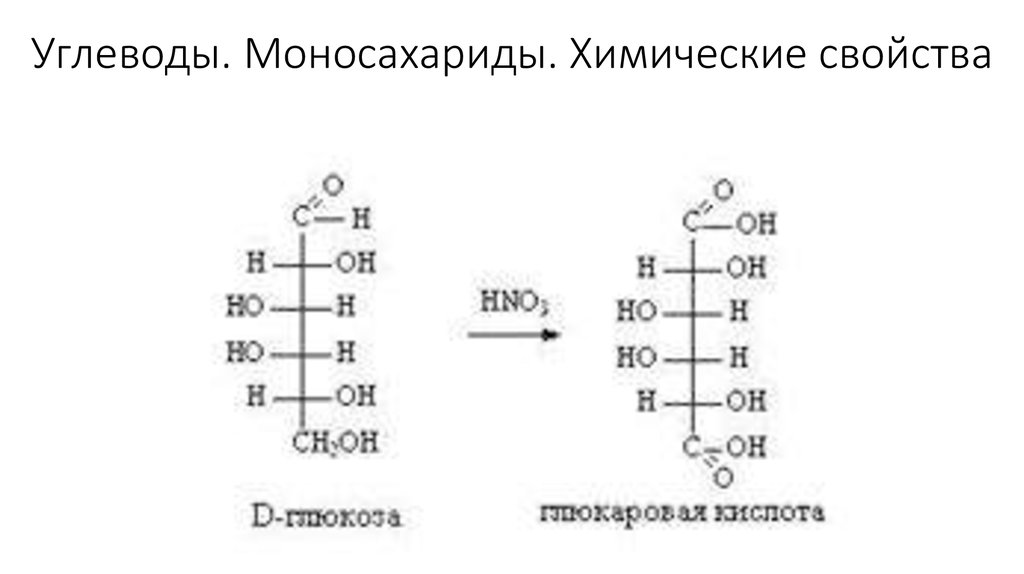
Подведение итогов
урока. 3
мин
Ход урока:
I. Организационный этап.
Приветствие,
диагностика состояния обучающихся, настрой на работу. Учитель сообщает цель и
задачи урока; проводит инструктаж по выполнению работы на уроке.
II. Проверка домашнего
задания.
Проверка домашнего задания устно у доски.
Опрос.
1. Что называется
жирами?
2.Физические и
химические свойства жиров?
3.Синтетические моющие средства.
III. Актуализация опорных знаний.
Мотивация учебной деятельности.
Беседа.
В курсе биологии вы уже знакомились с
углеводами, давайте вспомним основные понятия.
1. Что вы знаете о составе углеводов?
2. Что вы знаете о физических свойствах
углеводов?
3. Что вы знаете о биологическом значении
Что вы знаете о биологическом значении
углеводов?
IV. Изучение нового материала.
Параллельно
с изучением новой темы просматриваем презентацию по данной теме.
1. Понятие об углеводах.
Совместно с учителем обучающиеся
дают определение углеводам, записывают в тетрадь.
Углеводами называют
вещества с общей формулой Cx(H2O)y, где x и y
– натуральные числа. Название «углеводы» говорит о том, что в их молекулах
водород и кислород находятся в том же отношении, что и в воде.В животных
клетках содержится небольшое количество углеводов, а в растительных – почти
70 % от общего количества органических веществ.
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
ПРОСТЫЕ СЛОЖНЫЕ
моносахариды (дисахариды,
полисахариды)
Проблемный
вопрос: Какие функциональные группы содержатся в углеводах – моносахаридах. Находим
Находим
ответ на вопрос совместно. Исходя из химических свойств, характерных для
глюкозы и фруктозы (качественные реакции) делаем вывод о наличии функциональных
групп. Этот вопрос рассмотрим позже. Моносахариды – гетерофункциональные
соединения, в состав их молекул входит одна карбонильная группа (альдегидная
или кетонная) и несколько гидроксильных.
Наиболее
распространены моносахариды, в молекулах которых содержится пять углеродных
атомов (пентозы) или шесть (гексозы).
Например:
Из этих формул
следует, что моносахариды – это альдегидоспирты или кетоноспирты.
2. Строение
глюкозы C6H12O6
Экспериментально
установлено, что в молекуле глюкозы присутствуют альдегидная и гидроксильная
группы.
В результате
взаимодействия карбонильной группы с одной из гидроксильных глюкоза может
существовать в двух формах: открытой цепной и циклической.
В растворе глюкозы
эти формы находятся в равновесии друг с другом.
Например, в водном
растворе глюкозы существуют следующие структуры:
Циклические α-
и β — формы глюкозы представляют собой пространственные изомеры, отличающиеся
положением полуацетального гидроксила относительно плоскости кольца. В
α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе
-СН2ОН, в β-глюкозе – в цис-положении. С учетом пространственного
строения шестичленного цикла формулы этих изомеров имеют вид:
В твёрдом
состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза –
это α- форма. В растворе более устойчива β-форма (при установившемся равновесии
на неё приходится более 60% молекул). Доля альдегидной формы в равновесии
незначительна.
Для глюкозы характерна
межклассовая изомерия – фруктоза.
Строение
фруктозы.
Фруктоза —
изомер и «близкий родственник» глюкозы. Она хорошо растворима в воде, имеет
сладкий вкус (примерно в 3 раза слаще глюкозы).
Фруктоза также
наиболее часто встречается в циклических формах (α- или β) но, в отличие от
глюкозы, в пятичленных.
Фруктоза и
глюкоза в больших количествах содержатся в сладких фруктах, пчелином меде.
Физические
свойства глюкозы:
Глюкоза –
бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус
(лат. «глюкос» – сладкий):
1) она встречается
почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много
глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в
животных организмах;
4) в крови
человека ее содержится примерно 0,1 %.
Получение
глюкозы.
В
промышленности. Гидролиз крахмала:
(C6H10O5)n
+ nH2O t,H+→ nC6H12O6
крахмал глюкоза
В
лаборатории. Из
Из
формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→
C6H12O6
формальдегид
В природе. Фотосинтез:
6CO2 +
6H2O hν, хлорофилл → C6H12O6
+ 6O2
Другие
способы. Гидролиз
дисахаридов:
C12H22O11
+ H2O t,H+→ 2C6H12O6
мальтоза
глюкоза
C12H22O11
+ H2O t,H+→ C6H12O6 + C6H12O6
сахароза
глюкоза фруктоза
Химические
свойства глюкозы.
I.
Специфические свойства.
Важнейшим
свойством моносахаридов является их ферментативное брожение, т. е. распад
е. распад
молекул на осколки под действием различных ферментов. Брожение происходит в
присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или
плесневыми грибками. В зависимости от природы действующего фермента различают
реакции следующих видов:
1.Спиртовое
брожение:
C6H12O6
→ 2C2H5OH + 2CO2↑
2. Молочнокислое
брожение:
2C3H6O3
→ C6H12O6
3. Маслянокислое
брожение:
C6H12O6
→ C3H7COOH + 2H2↑+ 2CO2↑
II.
Свойства альдегидов.
1. Реакция
серебряного зеркала:
СH2OH(CHOH)4-COH
+ Ag2O t.Nh4→ СH2OH(CHOH)4-COOH +
2Ag↓
глюконовая кислота
2. Окисление
гидроксидом меди
(II):
СH2OH(CHOH)4-COH
+ 2Cu(OH)2t → СH2OH(CHOH)4-COOH +
Cu2O + 2H2O
голубой красный 3.
Восстановление:
СH2OH(CHOH)4-COH + H2t,Ni → СH2OH(CHOH)4CH2OH
сорбит – шестиатомный спирт
III.
Свойства многоатомных спиртов.
и при
обычных условиях:
1. Качественная
реакция многоатомных спиртов.
Прильём к
раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи.
Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В
данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как
многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
(глюкозат меди (II) – синий раствор)
3. Применение
глюкозы.
Глюкоза
является ценным питательным продуктом. В организме она подвергается сложным
В организме она подвергается сложным
биохимическим превращениям в результате которых образуется углекислый газ и
вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза
легко усваивается организмом, её используют в медицине в качестве укрепляющего
лечебного средства при явлениях сердечной слабости, шоке, она входит в состав
кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в
кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в
текстильной промышленности в качестве восстановителя, в качестве исходного
продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда
производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы.
Так, например, при квашении капусты, огурцов, молока происходит молочнокислое
брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая
силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха
происходит маслянокислое брожение и корм становится непригоден к применению. На
На
практике используется также спиртовое брожение глюкозы, например при
производстве пива.
4. Сахароза.
Нахождение в природе. Свойства, применение.
Примером наиболее
распространенных в природе дисахаридов (олигосахаридом) является сахароза
(свекловичный или тростниковый сахар).
Олигосахариды
– это продукты конденсации двух или нескольких молекул моносахаридов.
Дисахариды
– это углеводы, которые при нагревании с водой в присутствии минеральных кислот
или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы
моносахаридов.
Физические
свойства и нахождение в природе.
1. Она
представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в
воде.
2. Температура
плавления сахарозы 160 °C.
3. При застывании
расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во
многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной
свекле и сахарном тростнике.
Строение и
химические свойства.
1. Молекулярная
формула сахарозы – С12Н22О11
2. Сахароза имеет
более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков
глюкозы и фруктозы, соединенных друг с другом.
3. Наличие
гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с
гидроксидами металлов.
Лабораторные
опыты: 11. Взаимодействие сахарозы с гидроксидом меди (II).
Если раствор
сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата
меди (качественная реакция многоатомных спиртов 4. Альдегидной группы в
сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не
дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует
красного оксида меди (I).
5. Сахароза, в
отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не
вступает в реакцию «серебряного зеркала», так как не способна
превращаться в открытую форму, содержащую альдегидную группу. Подобные
Подобные
дисахариды не способны окисляться (т.е. быть восстановителями) и называются
невосстанавливающими сахарами.
6. Сахароза
является важнейшим из дисахаридов.
7. Она получается
из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или
из сахарного тростника. Реакция
сахарозы с водой.
Важное
химическое свойство сахарозы – способность подвергаться гидролизу (при
нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы
образуется молекула глюкозы и молекула фруктозы:
С12Н22О11
+ Н2О t, h3SO4→ С6Н12O6
+ С6Н12O6
Таким образом,
реакция гидролиза дисахаридов является обратной процессу их образования из
моносахаридов.
Из числа изомеров
сахарозы, имеющих молекулярную формулу С12Н22О11,
можно выделить мальтозу и лактозу.
Применение
сахарозы.
· Продукт
питания;
· В
кондитерской промышленности;
· Получение
искусственного мёда.
V. Первичное применение полученных
знаний.
Составление
уравнений реакций по цепочкам превращений:
1 ряд: Углекислый
газ → глюкоза → этанол →этилпропанат → углекислый газ;
2 ряд: Метаналь →
глюкоза → молочная кислота→ углекислый газ;
3 ряд: Сахароза →
глюкоза →этанол → этилен → бромэтан.
VI. Домашнее
задание.
Изучить материал
темы по учебнику, выполнить задания после параграфа. Подготовить презентацию:
сравнение строения и свойств крахмала и целлюлозы.
VII. Подведение итогов урока.
Подведение итогов урока.
Предлагаю обучающимся следующий
рефлексивный тест:
1. Я узнал (узнала) много нового.
2. Мне это пригодится в жизни.
3. На уроке было о чём подумать.
4. На все вопросы, которые возникли на
уроке, я нашёл (-ла) ответы.
5. На уроке я поработал (-ла) отлично и
цели урока достиг (-ла).
Свойства фруктозы
Фруктоза относится к простейшей форме сахароподобного моносахарида, содержащегося в различных продуктах. Он считается одним из важных сахаров крови, включая глюкозу и галактозу. Фруктоза содержится в меде, плодах деревьев, ягодах, дынях и некоторых корнеплодах, таких как сладкий картофель и свекла, часто в сочетании с глюкозой и сахарозой.
Фруктоза производится путем расщепления сахарозы, дисахарида, состоящего из фруктозы и глюкозы. Он далее расщепляется в процессе пищеварения с помощью ферментов гликозидгидролазы.
В этой статье будут рассмотрены различные вопросы о фруктозе с физическими свойствами фруктозы, структурой и примерами фруктозы.
Фруктоза
Фруктоза — это простой «кетоновый моносахаридный сахар», содержащийся в некоторых растениях, цветах и фруктах. Это фруктовый сахар, который вместе с глюкозой и галактозой является одним из трех диетических моносахаридов, непосредственно всасывающихся в кровь во время пищеварения.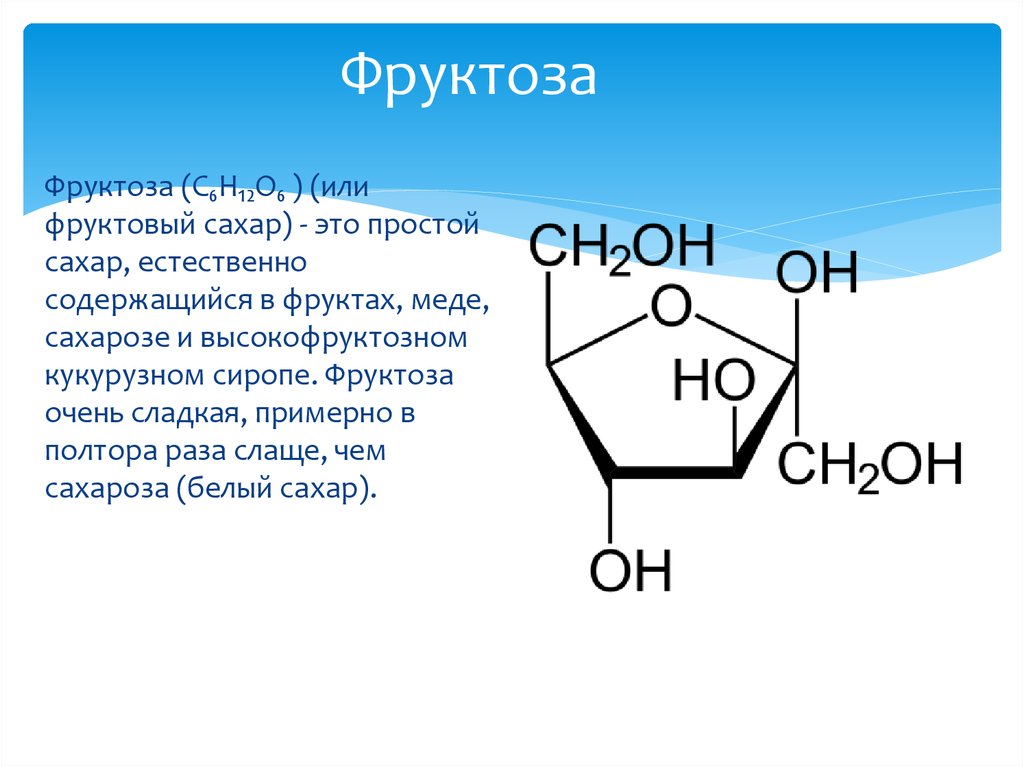
Моносахариды являются основной единицей углеводов и типичным примером сахара. В результате фруктоза является самым основным сахаром и легче усваивается, чем другие сахара. Это приятное белое кристаллическое вещество без запаха в чистом виде. Он лучше растворим в воде, чем другие сахара.
Он обычно содержится во многих продуктах, таких как личи, черри-манго, гуава и овощах, таких как морковь, свекла, редис и сахарный тростник. В промышленных масштабах его получают из кукурузы, сахарного тростника и сахарной свеклы.
Фруктоза, как и все моносахариды, является понижающим сахаром. Гликация, или случайное присоединение отдельных молекул сахара к белкам, является серьезной причиной повреждений у диабетиков.
Фруктоза в этом аспекте так же вредна, как и глюкоза, и, следовательно, не является решением для лечения диабета. Это может играть значительную роль в старении и многих возрастных хронических заболеваниях.
Физические свойства фруктозы
Кристаллы фруктозы имеют кольцевую конфигурацию. Это полигидроксикетон с шестью атомами углерода. «Полукеталь и внутренняя водородная связь» помогают ему быть прочным. В этой форме он известен как D-фруктопираноза. В своем водном растворе фруктоза существует в виде равновесной комбинации 70% фруктопиранозы, 22% фруктофурананов и 7% трех дополнительных форм, таких как ее ациклические структуры. Шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода составляют фруктозу. При углеродном числе 2 у этого есть функциональная группа кетона. В результате получается кетогексоза. Его получают в сочетании с глюкозой.
Это полигидроксикетон с шестью атомами углерода. «Полукеталь и внутренняя водородная связь» помогают ему быть прочным. В этой форме он известен как D-фруктопираноза. В своем водном растворе фруктоза существует в виде равновесной комбинации 70% фруктопиранозы, 22% фруктофурананов и 7% трех дополнительных форм, таких как ее ациклические структуры. Шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода составляют фруктозу. При углеродном числе 2 у этого есть функциональная группа кетона. В результате получается кетогексоза. Его получают в сочетании с глюкозой.
Основные свойства фруктозы:
- Молекулярная масса 180,156 г.моль-1.
- Температура плавления 103 °C.
- Это самый водорастворимый сахар.
- Имеет сладкий вкус. Он используется в качестве натурального подсластителя в напитках и блюдах. Это самый дешевый и вкусный природный углевод. Его относительная сладость уменьшается с повышением температуры.
- При стандартной температуре представляет собой белое кристаллическое вещество.

- Сахар без запаха.
- Обладает высокой гигроскопичностью или способностью впитывать влагу из окружающей среды. По сравнению с другими сахарами он быстро поглощает влагу и медленно ее выделяет.
- Это хороший увлажнитель, что означает, что он может удерживать влагу. Он также может удерживать влагу, которая была поглощена.
- Дрожжи и бактерии могут сбраживать фруктозу анаэробно. Дрожжи расщепляют структуру сахара на углекислый газ и этанол.
- Демонстрирует реакцию Майяра. Поскольку он может оставаться в форме открытой цепи в течение более длительного периода, ранняя стадия «реакции Майяра» происходит быстрее.
- Может производить мутагенные химикаты.
- Фруктоза при обезвоживании дает гидроксиметилфурфурол.
Состав и структура фруктозы.
Изучение определения, обнаружения, структуры, свойств, использования
Дом
»Химия
Дивья Каре
| Обновлено: 18 октября 2022 г. 1:28 IST
0
Сохранить
Скачать публикацию в формате PDF
Фруктоза, часто известная как фруктовый сахар, представляет собой кетогенный простой сахар, который часто соединяется с глюкозой для получения дисахарида сахарозы.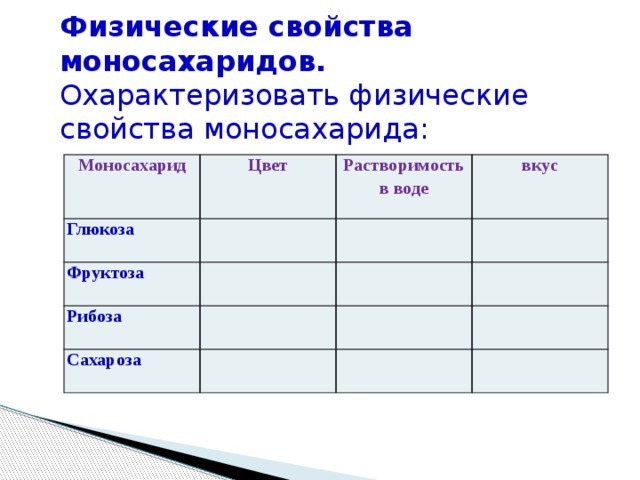 Наряду с глюкозой и галактозой это один из трех диетических моносахаридов, которые непосредственно всасываются в кровь после пищеварения. Французский химик Огюстен-Пьер Дюбрунфо открыл фруктозу в 1847 году. Английский химик Уильям Аллен Миллер впервые употребил термин «фруктоза» в 1857 году. Самый водорастворимый из всех сахаров, чистая, высушенная фруктоза — приятная, белая, кристаллическое твердое вещество без запаха. Фруктоза содержится в меде, плодах деревьев и винограда, цветах, ягодах и большинстве корнеплодов.
Наряду с глюкозой и галактозой это один из трех диетических моносахаридов, которые непосредственно всасываются в кровь после пищеварения. Французский химик Огюстен-Пьер Дюбрунфо открыл фруктозу в 1847 году. Английский химик Уильям Аллен Миллер впервые употребил термин «фруктоза» в 1857 году. Самый водорастворимый из всех сахаров, чистая, высушенная фруктоза — приятная, белая, кристаллическое твердое вещество без запаха. Фруктоза содержится в меде, плодах деревьев и винограда, цветах, ягодах и большинстве корнеплодов.
Фруктоза
Фруктоза является одним из простых кетоновых моносахаридов. Многочисленные растения, цветы и фрукты содержат простой кетоновый моносахаридный сахар, известный как фруктоза, — это простой моносахарид. Этот фруктовый сахар является одним из трех диетических моносахаридов, наряду с глюкозой и галактозой, которые непосредственно всасываются в кровь во время пищеварения. Простейший вид сахара и основной компонент углеводов называются моносахаридами.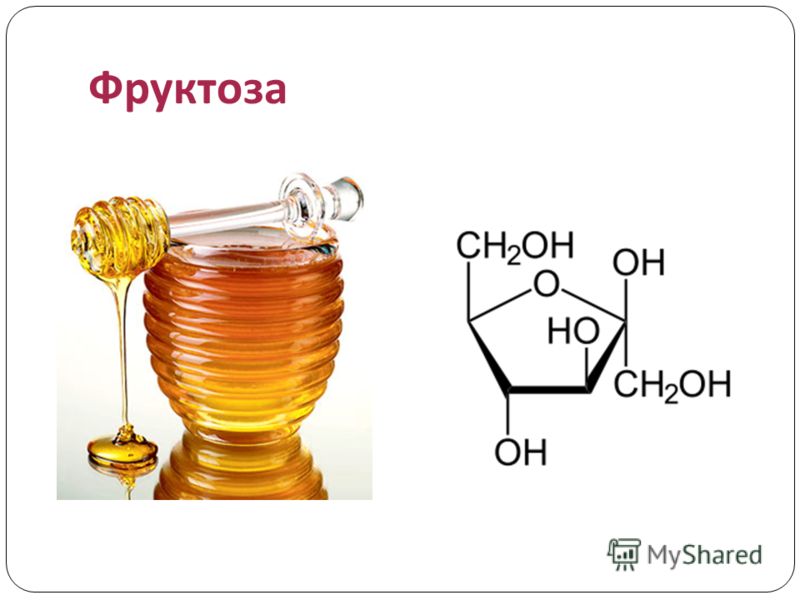 Фруктоза — самый простой сахар, а также самый легкий для переваривания сахар. Это сладкое, белое, безвкусное и кристаллическое твердое вещество в чистом виде. По сравнению с другими сахарами он лучше растворим в воде. Обычно он содержится в овощах, таких как морковь, редис, свекла и сахарный тростник, а также во фруктах, таких как манго, личи, вишня и гуава. Его производят из сахарной свеклы, кукурузы и тростника.
Фруктоза — самый простой сахар, а также самый легкий для переваривания сахар. Это сладкое, белое, безвкусное и кристаллическое твердое вещество в чистом виде. По сравнению с другими сахарами он лучше растворим в воде. Обычно он содержится в овощах, таких как морковь, редис, свекла и сахарный тростник, а также во фруктах, таких как манго, личи, вишня и гуава. Его производят из сахарной свеклы, кукурузы и тростника.
Фруктоза была открыта французским химиком Огюстеном-Пьером Дюбрунфо в 1847 году.
Структура фруктозы
Кольцевая структура
Кольцевую структуру можно увидеть в кристаллической фруктозе. Это полигидроксикетон с шестью атомами углерода. Полукеталь и внутренняя водородная связь помогают ему стать более стабильным. Хотя фруктоза встречается в водном растворе в виде равновесной смеси 70% фруктопиранозы, 22% фруктофуранозы и 7% трех других форм, включая ее ациклические структуры, в этой форме она известна как D-фруктопираноза.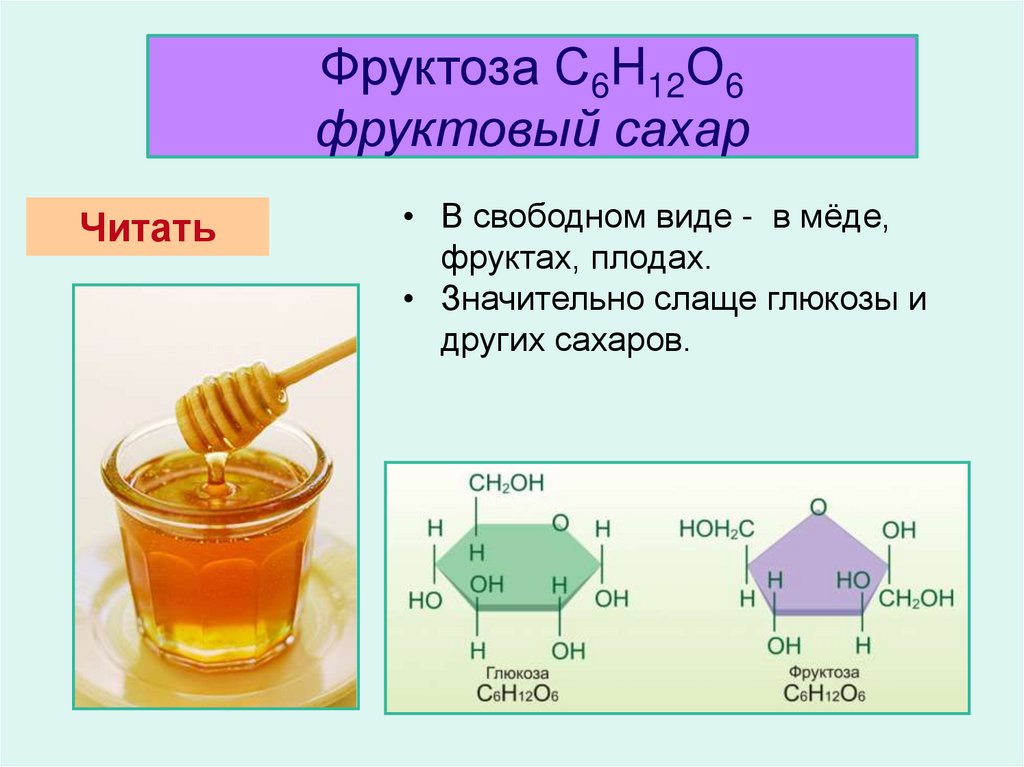
Циклическая структура
Шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода составляют фруктозу. При углеродном числе 2 он имеет кетоновую функциональную группу. В результате получается кетогексоза. Его можно получить с глюкозой. Фруктоза имеет химическую формулу \(C_6H_{12}O_6\).
Свойства фруктозы
Физические и химические свойства фруктозы обсуждаются ниже:
Физические свойства
Дисахарид сахароза гидролизуется с образованием фруктозы, незаменимой кетогексозы. Ниже приведен список физических свойств фруктозы:
- Молярная масса фруктозы составляет 180,156 г/моль.
- Точка плавления фруктозы 103°С.
- Это один из наиболее растворимых в воде сахаров.
- Имеет сладкий вкус. Из-за этого он используется в качестве подсластителя в продуктах питания и напитках. Это самый дешевый и вкусный природный углевод. Его относительная сладость уменьшается с повышением температуры.

- При комнатной температуре представляет собой кристаллическое твердое вещество белого цвета.
- Фруктоза – сахар без запаха.
- Масляный.
- Благодаря своей высокой гигроскопичности легко впитывает влагу из окружающей среды. В отличие от других сахаров, он быстро впитывает влагу и постепенно отдает ее.
Химические свойства
Учитывая, что фруктоза широко используется в пищевых продуктах и является компонентом нашего ежедневного рациона, крайне важно понимать все ее химические свойства. Ниже приведен список химических характеристик фруктозы:
- Дрожжи и бактерии обладают способностью анаэробно ферментировать фруктозу. Сахар трансформируется дрожжами в этанол и углекислый газ.
- На нем изображен ответ Майяра. Ранняя стадия реакции Майяра протекает быстрее, потому что она может оставаться в форме с открытой цепью в течение более длительного периода времени.
- Он может производить мутагенные химические вещества.

- Фруктоза производит гидроксиметилфурфурол (ГМФ) после обезвоживания.
Разница между глюкозой и фруктозой
Разница между глюкозой и фруктозой заключается в следующем:
| Глюкоза | Фруктоза | 9 | 9 Она также известна как виноградный сахар. | Также известен как фруктовый сахар. |
| Они менее липогенны. | Они более липогенны. |
| Они производят меньше жира. | Они производят больше жира. |
| Шестичленная кольцевая структура. | Пятичленная кольцевая структура. |
| Обычно образует кольцевую структуру пиранозы. | Обычно образует фурановую кольцевую структуру. |
Использование фруктозы
Существуют различные способы применения фруктозы, и некоторые из них мы рассмотрим здесь:
- Ее можно использовать как добавку к дизельному топливу, так и как само топливо, поскольку ее можно трансформировать.
 в гидроксиметилфурфурол (или «HMF»).
в гидроксиметилфурфурол (или «HMF»). - Фруктоза широко используется в качестве подсластителя в промышленности. Он служит подсластителем во многих блюдах. Его ценность как подсластителя повышается за счет того, что это низкокалорийный подсластитель.
- Также используется в полимерах.
- С помощью этой технологии можно продлить срок годности таких продуктов, как печенье и питательные батончики.
- Фруктоза используется для приготовления кукурузного сиропа.
- Фруктоза также используется в смесях для детского питания.
- Употребляется диабетиками в пищу.
- По сравнению с глюкозой и фруктозой имеет низкий гликемический индекс и вызывает умеренное выделение инсулина в кровоток.
- Он также используется во многих хлебобулочных изделиях, напитках и т. д.
Другие темы по химии можно найти на веб-сайте Testbook. Получите помощь от экспертов, чтобы подготовиться к экзаменам с избранными учебными материалами, пробными тестами и ценными советами, которые помогут вам получить более высокие оценки на экзамене. Загрузите бесплатное приложение Testbook, чтобы получить эксклюзивные предложения прямо сейчас.
Загрузите бесплатное приложение Testbook, чтобы получить эксклюзивные предложения прямо сейчас.
Часто задаваемые вопросы о фруктозе
В.1 Является ли фруктоза восстанавливающим сахаром?
Ответ 1 Да, фруктоза является редуцирующим сахаром.
Q.2 Для чего используется фруктоза?
Ответ 2 Он также используется в полимерах, производстве кукурузного сиропа, используется в смесях для детского питания, а также потребляется диабетиками в качестве пищи.
Q.3 Каковы источники фруктозы?
Ответ 3 Фрукты, фруктовые соки, некоторые овощи и мед являются источниками фруктозы.
Q.4 Является ли фруктоза моносахаридом?
Отв.4 Да, фруктоза — это моносахарид.
В.5 Из чего состоит фруктоза?
Ans.5 В водном растворе состоит из 70% пиранозы, 22% фуранозы и меньшего количества линейных и других циклических форм.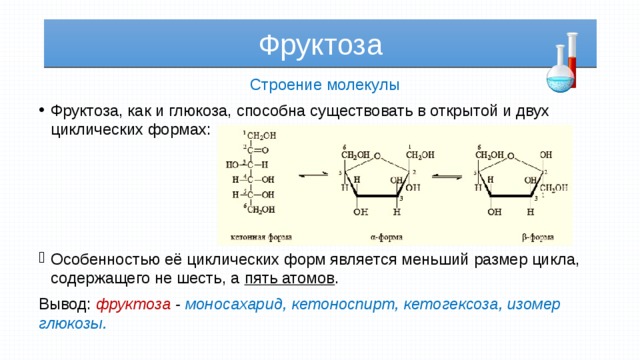


 в гидроксиметилфурфурол (или «HMF»).
в гидроксиметилфурфурол (или «HMF»).