Содержание
Формула Глутаминовой кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C5H9NO4
Химический состав Глутаминовой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12.011 | 5 | 40,8% |
| H | Водород | 1.008 | 9 | 6,2% |
| N | Азот | 14.007 | 1 | 9,5% |
| O | Кислород | 15.999 | 4 | 43,5% |
Молекулярная масса: 147.13
УГлутаминовая кислота (2-аминопентандиовая кислота) — алифатическая дикарбоновая аминокислота. В живых организмах глутаминовая кислота входит в состав белков, ряда низкомолекулярных веществ и в свободном виде. Глутаминовая кислота играет важную роль в азотистом обмене. Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание глутамата со специфическими рецепторами нейронов приводит к возбуждению последних. Глутаминовая кислота относится к группе заменимых аминокислот и играет важную роль в организме. Её содержание в организме составляет до 25% от всех аминокислот.
В живых организмах глутаминовая кислота входит в состав белков, ряда низкомолекулярных веществ и в свободном виде. Глутаминовая кислота играет важную роль в азотистом обмене. Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание глутамата со специфическими рецепторами нейронов приводит к возбуждению последних. Глутаминовая кислота относится к группе заменимых аминокислот и играет важную роль в организме. Её содержание в организме составляет до 25% от всех аминокислот.
Глутаминовая кислота представляет собой белое кристаллическое вещество, плохо растворимое в воде, этаноле, нерастворимое в ацетоне и диэтиловом эфире.
Глутамат (соль глутаминовой кислоты) — наиболее распространенный возбуждающий нейротрансмиттер в нервной системе позвоночных. В химических синапсах глутамат запасается в пресинаптических пузырьках (везикулах). Нервный импульс запускает высвобождение глутамата из пресинаптического нейрона. На постсинаптическом нейроне глутамат связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности глутамат вовлечен в такие когнитивные функции, как обучение и память. Одна из форм синаптической пластичности, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга. Глутамат участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объемной нейротрансмиссии, когда сигнал передается в соседние синапсы путём суммации глутамата, высвобожденного в соседних синапсах (так называемая экстрасинаптическая или объемная нейротрансмиссия) В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном. Транспортёры глутамата обнаружены на нейрональных мембранах и мембранах нейроглии. Они быстро удаляют глутамат из внеклеточного пространства.
На постсинаптическом нейроне глутамат связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности глутамат вовлечен в такие когнитивные функции, как обучение и память. Одна из форм синаптической пластичности, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга. Глутамат участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объемной нейротрансмиссии, когда сигнал передается в соседние синапсы путём суммации глутамата, высвобожденного в соседних синапсах (так называемая экстрасинаптическая или объемная нейротрансмиссия) В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном. Транспортёры глутамата обнаружены на нейрональных мембранах и мембранах нейроглии. Они быстро удаляют глутамат из внеклеточного пространства. При повреждении мозга или заболеваниях они могут работать в противоположном направлении, вследствие чего глутамат может накапливаться снаружи клетки. Этот процесс приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что, в свою очередь, вызывает повреждение и даже гибель клетки — что получило название эксайтотоксичности. Механизмы клеточной смерти при этом включают:
При повреждении мозга или заболеваниях они могут работать в противоположном направлении, вследствие чего глутамат может накапливаться снаружи клетки. Этот процесс приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что, в свою очередь, вызывает повреждение и даже гибель клетки — что получило название эксайтотоксичности. Механизмы клеточной смерти при этом включают:
- повреждение митохондрий избыточно высоким внутриклеточным кальцием,
- Glu/Ca2+-опосредованной промоцией факторов транскрипции проапоптотических генов или снижением транскрипции анти-апоптотических генов.
Эксайтотоксичность, обусловленная повышенным высвобождением глутамата или его сниженным обратным захватом, возникает при ишемическом каскаде и ассоциирована с инсультом, а также наблюдается при таких заболеваниях, как боковой амиотрофический склероз, латиризм, аутизм, некоторые формы умственной отсталости, болезнь Альцгеймера.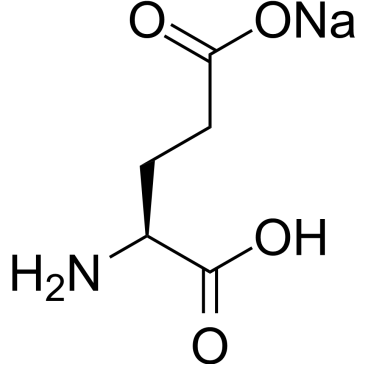 В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии глутаматных рецепторов. Глутаминовая кислота участвует в реализации эпилептического припадка. Микроинъекция глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию, и этот паттерн напоминает пароксизмальную деполяризацию во время судорог. Эти изменения в эпилептическом очаге приводят к открытию вольтаж-зависимых кальциевых каналов, что снова стимулирует выброс глутамата и дальнейшую деполяризацию. Роли глутаматной системы в настоящее время отводится большое место в патогенезе таких психических расстройств, как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза NMDA-рецепторной гипофункции: при применении антагонистов NMDA-рецепторов, таких, как фенциклидин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что гипофункция NMDA-рецепторов является одной из причин нарушений в дофаминергической передаче у больных шизофренией.
В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии глутаматных рецепторов. Глутаминовая кислота участвует в реализации эпилептического припадка. Микроинъекция глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию, и этот паттерн напоминает пароксизмальную деполяризацию во время судорог. Эти изменения в эпилептическом очаге приводят к открытию вольтаж-зависимых кальциевых каналов, что снова стимулирует выброс глутамата и дальнейшую деполяризацию. Роли глутаматной системы в настоящее время отводится большое место в патогенезе таких психических расстройств, как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза NMDA-рецепторной гипофункции: при применении антагонистов NMDA-рецепторов, таких, как фенциклидин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что гипофункция NMDA-рецепторов является одной из причин нарушений в дофаминергической передаче у больных шизофренией.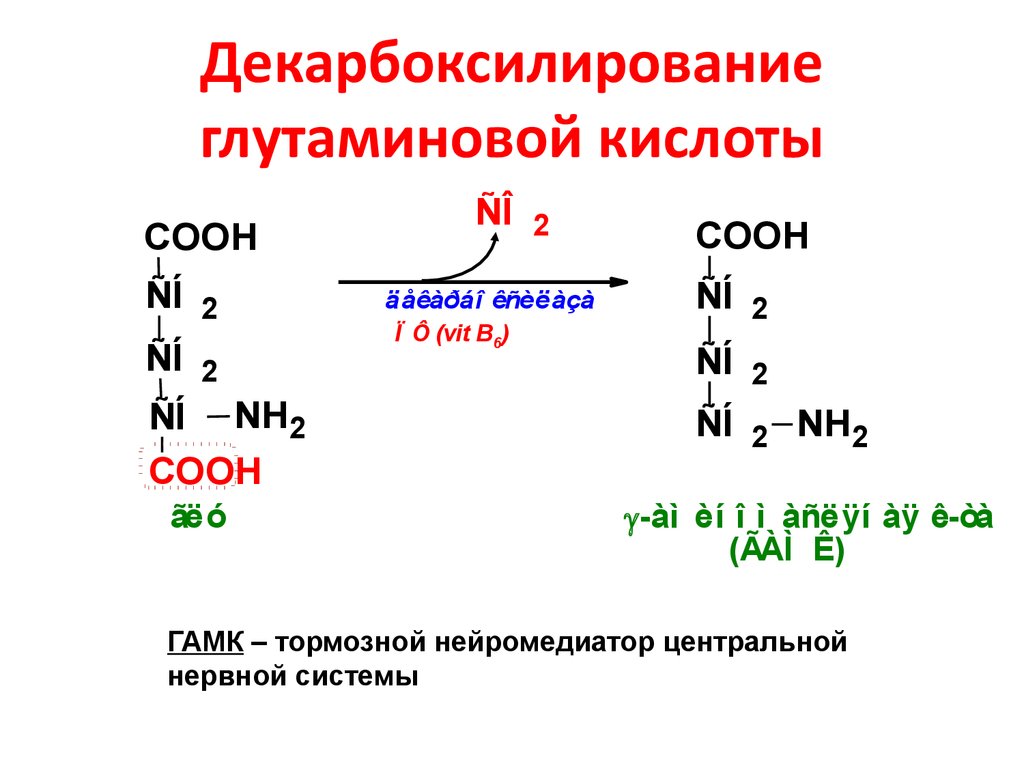 Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет клинику острой шизофрении. В этиопатогенезе эндогенной депрессии, считается[кем?], играет роль избыточная глутаматергическая нейротрансмиссия, подтверждением чему является эффективность диссоциативного анестетика кетамина при однократном применении при резистентной к лечению депрессии в эксперименте.
Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет клинику острой шизофрении. В этиопатогенезе эндогенной депрессии, считается[кем?], играет роль избыточная глутаматергическая нейротрансмиссия, подтверждением чему является эффективность диссоциативного анестетика кетамина при однократном применении при резистентной к лечению депрессии в эксперименте.
Существуют ионотропные и метаботропные (mGLuR 1—8) глутаматные рецепторы. Ионотропными рецепторами являются NMDA-рецепторы, AMPA-рецепторы и каинатные рецепторы. Эндогенные лиганды глутаматных рецепторов — глутаминовая кислота и аспарагиновая кислота. Для активации NMDA рецепторов также необходим глицин. Блокаторами NMDA-рецепторов являются PCP, кетамин, и другие вещества. AMPA-рецепторы также блокируются CNQX, NBQX. Каиновая кислота является активатором каинатных рецепторов.
При наличии глюкозы в митохондриях нервных окончаний происходит дезаминирование глутамина до глутамата при помощи фермента глутаминазы. Также при аэробном окислении глюкозы глутамат обратимо синтезируется из альфа-кетоглутарата (образуется в цикле Кребса) при помощи аминотрансферазы. Синтезированный нейроном глутамат закачивается в везикулы. Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы глутамата при помощи везикулярного транспортера глутамата (VGLUTs). Глутамат выводится в синаптическую щель, откуда поступает в астроциты, там трансаминируется до глутамина. Глутамин выводится снова в синаптическую щель и только тогда захватывается нейроном. По некоторым данным, глутамат напрямую путём обратного захвата не возвращается.
Также при аэробном окислении глюкозы глутамат обратимо синтезируется из альфа-кетоглутарата (образуется в цикле Кребса) при помощи аминотрансферазы. Синтезированный нейроном глутамат закачивается в везикулы. Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы глутамата при помощи везикулярного транспортера глутамата (VGLUTs). Глутамат выводится в синаптическую щель, откуда поступает в астроциты, там трансаминируется до глутамина. Глутамин выводится снова в синаптическую щель и только тогда захватывается нейроном. По некоторым данным, глутамат напрямую путём обратного захвата не возвращается.
Дезаминирование глутамина до глутамата при помощи фермента глутаминазы приводит к образованию аммиака, который, в свою очередь, связывается со свободным протоном и экскретируется в просвет почечного канальца, приводя к снижению ацидоза. Превращение глутамата в α-кетоглутарат также происходит с образованием аммиака. Далее кетоглутарат распадается на воду и углекислый газ. Последние, при помощи карбоангидразы через угольную кислоту, превращаются в свободный протон и гидрокарбонат. Протон экскретируется в просвет почечного канальца за счет котранспорта с ионом натрия, а бикарбонат попадает в плазму.
Далее кетоглутарат распадается на воду и углекислый газ. Последние, при помощи карбоангидразы через угольную кислоту, превращаются в свободный протон и гидрокарбонат. Протон экскретируется в просвет почечного канальца за счет котранспорта с ионом натрия, а бикарбонат попадает в плазму.
В ЦНС находится порядка 106 глутаматергических нейронов. Тела нейронов лежат в коре головного мозга, обонятельной луковице, гиппокампе, чёрной субстанции, мозжечке. В спинном мозге — в первичных афферентах дорзальных корешков. В ГАМКергических нейронах глутамат является предшественником тормозного медиатора, гамма-аминомасляной кислоты, образующейся с помощью фермента глутаматдекарбоксилазы.
Повышенное содержание глутамата в синапсах между нейронами может перевозбудить и даже убить эти клетки, что приводит к таким заболеваниям, как АЛС. Для избежания таких последствий глиальные клетки астроциты поглощают избыток глутамата. Он транспортируется в эти клетки с помощью транспортного белка GLT1, который присутствует в клеточной мембране астроцитов. Будучи поглощённым клетками астроглии, глутамат больше не приводит к повреждению нейронов.
Будучи поглощённым клетками астроглии, глутамат больше не приводит к повреждению нейронов.
Глутаминовая кислота относится к условно незаменимым аминокислотам. Глутамат в норме синтезируется организмом. Присутствие в пище свободного глутамата придает ей так называемый «мясной» вкус, для чего глутамат используют как усилитель вкуса. При этом метаболизм природного глутамата и глутамата синтетического не отличается. Содержание натуральных глутаматов в пище (имеется в виду пища, не содержащая искусственно добавленного глутамата натрия):
| Продукт | Связанный глутамат | Свободный глутамат |
|---|---|---|
| Сыр пармезан | 9847 | 1200 |
| Зеленый горошек | 5583 | 200 |
| Мясо утки | 3636 | 69 |
| Мясо цыпленка | 3309 | 44 |
| Говядина | 2846 | 33 |
| Макрель | 2382 | 36 |
| Свинина | 2325 | 23 |
| Форель | 2216 | 20 |
| Треска | 2101 | 9 |
В промышленных масштабах глутаминовую кислоту получают путём микробиологического синтеза.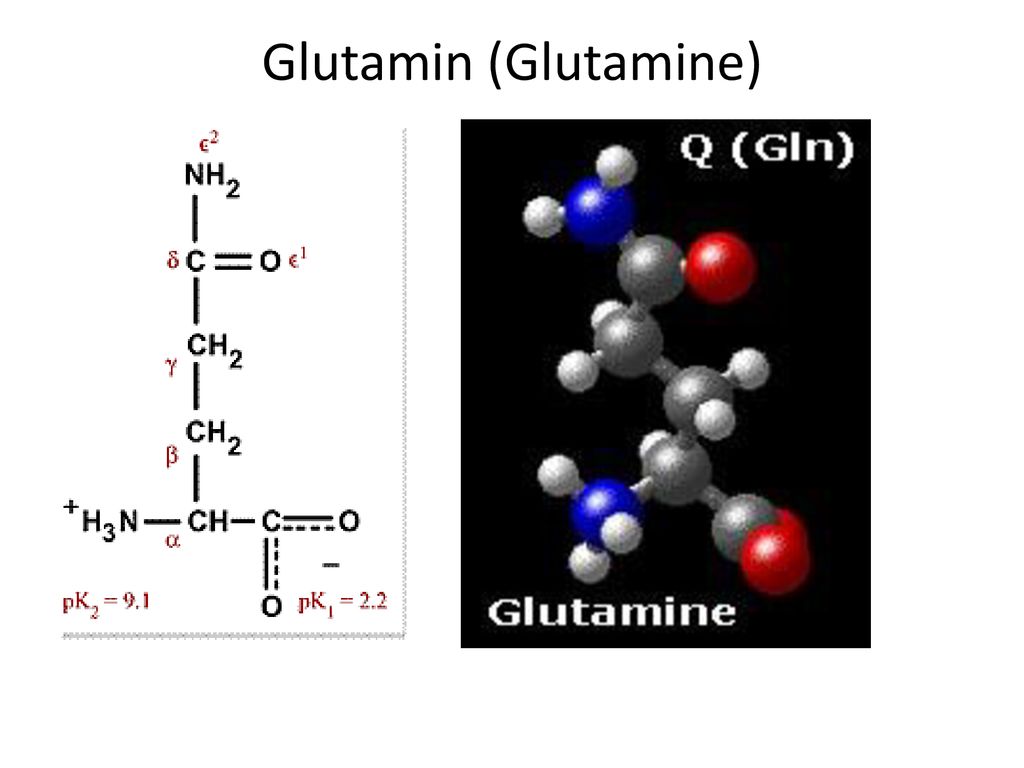 В химически чистом виде она имеет вид белых или бесцветных кристаллов без запаха, имеющих кислый вкус, в воде кристаллы растворяются плохо. Для лучшей растворимости глутаминовую кислоту превращают в соль натрия – глутамат.
В химически чистом виде она имеет вид белых или бесцветных кристаллов без запаха, имеющих кислый вкус, в воде кристаллы растворяются плохо. Для лучшей растворимости глутаминовую кислоту превращают в соль натрия – глутамат.
Фармакологический препарат глутаминовой кислоты оказывает умеренное психостимулирующее, возбуждающее и отчасти ноотропное действие. Глутаминовая кислота (пищевая добавка E620) и её соли (глутамат натрия Е621, глутамат калия Е622, диглутамат кальция Е623, глутамат аммония Е624, глутамат магния Е625) используются как усилитель вкуса во многих пищевых продуктах. Глутаминовую кислоту и ее соли добавляют в полуфабрикаты, различные продукты быстрого приготовления, кулинарные изделия, концентраты бульонов. Она придает пище приятный мясной вкус. В медицине применение глутаминовой кислоты оказывает незначительное психостимулирующее, возбуждающее и ноотропное действие, что используют в лечении ряда заболеваний нервной системы. В середине 20 века врачи рекомендовали применение глутаминовой кислоты внутрь в случае мышечно-дистрофических заболеваний.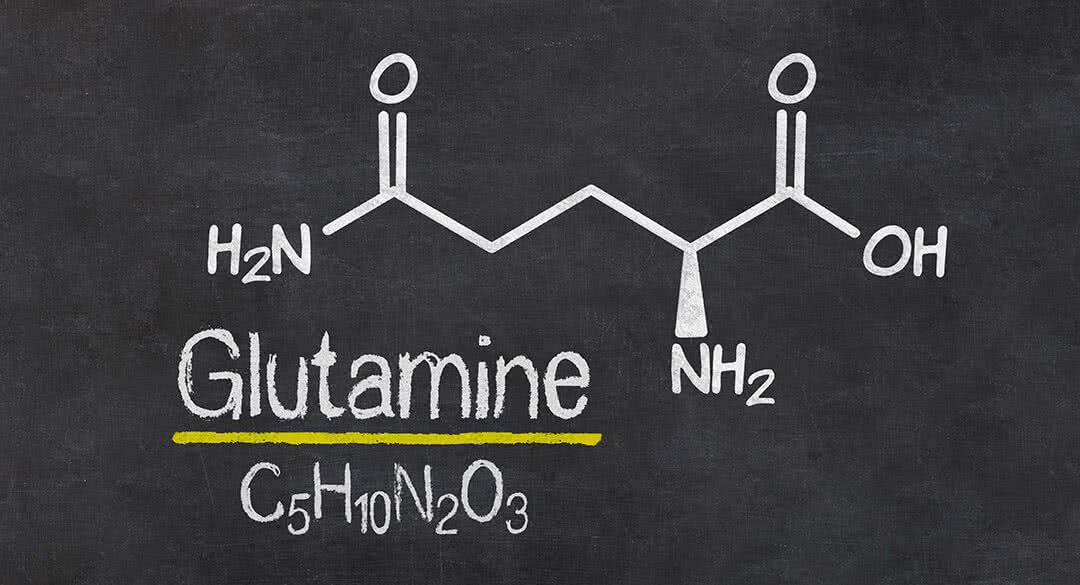 Также её назначали спортсменам с целью увеличения мышечной массы. Глутаминовая кислота используется в качестве хирального строительного блока в органическом синтезе, в частности, дегидратация глутаминовой кислоты приводит к её лактаму ― пироглутаминовой кислоте (5-оксопролину), которая является ключевым предшественником в синтезах неприродных аминокислот, гетероциклических соединений, биологически активных соединений и т. д.
Также её назначали спортсменам с целью увеличения мышечной массы. Глутаминовая кислота используется в качестве хирального строительного блока в органическом синтезе, в частности, дегидратация глутаминовой кислоты приводит к её лактаму ― пироглутаминовой кислоте (5-оксопролину), которая является ключевым предшественником в синтезах неприродных аминокислот, гетероциклических соединений, биологически активных соединений и т. д.
Протеиногенные аминокислоты
Протеиногенные аминокислоты
Протеиногенные аминокислоты
Назад в
справочник
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Назад в
справочник
Хостинг от uCoz
[Глютамин]
Общедоступно
Опубликовано
2017
- EintragstypEntry Type
- Chemical Compound
- EintragsspracheEntry Language
- EnglischEnglish
- SchlagwortKeyword
- Химическое соединение; Глутамин
- ИнЧИ
- ИнЧИ=1S/C5h20N2O3/c6-3(5(9)10)1-2-4(7)8/h4H,1-2,6h3,(h3,7,8)(H, 9,10)/t3-/м0/с1; ZDXPYRJPNDTMRX-VKHMYHEASA-N
кислота
глютамин
L-(+)-глутамин
ИД 5961
Глютамин
Источник: Национальный центр биотехнологической информации.
База данных соединений PubChem; CID=5961, https://pubchem.ncbi.nlm.nih.gov/compound/5961
Дополнительную информацию см. на сайте PubChem Compound.
База данных
Найти в базе данных IUPAC
Выпуск 93/2021
Глоссарий и учебник по
Термины метаболизма ксенобиотиков, используемые при открытии низкомолекулярных лекарств и
Разработка6 Ацилирование
15 аминокислот
Спряжение92 глютамин
Спряжение96 конъюгация глицина
208 Сериновая конъюгация
226 Трансфераза
Выпуск 86/2014
Структурные аспекты
Молекулярное распознавание в иммунной системе. Часть I: Приобретено
Часть I: Приобретено
Иммунитет
Выпуск 78/2006
Глоссарий терминов, относящихся к
пестициды
Выпуск 72/2000
Свойства и единицы в
Клинические лабораторные науки. Часть X. Свойства и единицы в целом
Клиническая химия
Выпуск 69/1997
Аминокислотный остаток (в
Полипептид)Использование стабильных изотопов в
Отсутствие изотопных эффектов
Выпуск 67/1995
Смешиваемый с водой органический
РастворителиКритическая оценка
Константы устойчивости металлокомплексов аминокислот с полярной стороной
ЦепиЦистеин
Цистин
Метонин
серин
Треонин
Аспарагин
глютамин
Выпуск 64/1992
Взаимосвязи химии
и биотехнологии — III. Методы очистки биологических
Методы очистки биологических
Товары
Выпуск 63/1991
Мессбауэровская спектроскопия
Выпуск 56/1984
Первичные алкил- и
Ариламины и N-аминокислоты (флуориметрия)Аминокислота
НоменклатураНоменклатура непептидных
Производные аминокислотНоменклатура пептидов
Однобуквенная система
Выпуск 40/1974
Боковые цепи
Символы для аминокислот
Производные и пептиды (утвержденные правила 1974)
Выпуск 11/1965
Номенклатура органических
Химия (Окончательные правила для раздела C. Группы характеристик
Группы характеристик
Содержит углерод, водород, кислород, азот, галоген, серу, селен,
и/или теллур)Карбоновые кислоты и их
Производные
QuelleSource
- Название
- Химические соединения
- VerlagPublisher
- 2016
Запись в базе данных
[Глютамин]
- МДА
- АПА
- Гарвард
- Чикаго
- Ванкувер
Скопировано в буфер обмена
Дополнительные материалы
Пожалуйста, войдите или зарегистрируйтесь в De Gruyter, чтобы заказать этот продукт.
ВойтиРегистрация
PDB-101: Молекула месяца: Глутаминсинтетаза
Молекула месяца
| По категориям | По дате | По названию |
Глутаминсинтетаза отслеживает уровень аминокислот, богатых азотом, и решает, когда следует производить больше
Глутаминсинтетаза. Сайт модификации рибозилированием АДФ показан стрелкой.
Скачать изображение в формате TIFF в высоком качестве
Наши клетки постоянно сталкиваются с изменяющейся средой. Подумайте о том, что вы едите. В некоторые дни вы можете есть много белков, в другие дни вы можете есть много углеводов. Иногда вы можете не есть ничего, кроме шоколада. Ваше тело должно быть в состоянии реагировать на эти различные продукты, производя соответствующие ферменты для захвата питательных веществ в каждом из них. То же самое вдвойне верно для мелких организмов, таких как бактерии, у которых не так много вариантов выбора рациона. Они должны съесть любую пищу, оказавшуюся поблизости, а затем мобилизовать ферменты, необходимые для ее использования.
То же самое вдвойне верно для мелких организмов, таких как бактерии, у которых не так много вариантов выбора рациона. Они должны съесть любую пищу, оказавшуюся поблизости, а затем мобилизовать ферменты, необходимые для ее использования.
Молекулярный компьютер
Фермент глутаминсинтетаза является ключевым ферментом, контролирующим использование азота внутри клеток. Глютамин не только используется для построения белков, но и доставляет атомы азота к ферментам, которые строят богатые азотом молекулы, такие как основания ДНК и аминокислоты. Таким образом, глутаминсинтетазу, фермент, который строит глютамин, необходимо тщательно контролировать. Когда нужен азот, его нужно включать, чтобы клетка не голодала. Но когда азота в клетке достаточно, его нужно отключить, чтобы избежать перенасыщения.
Глутаминсинтетаза действует как крошечный молекулярный компьютер, отслеживая количество молекул, богатых азотом. Он отслеживает уровни аминокислот, таких как глицин, аланин, гистидин и триптофан, и уровни нуклеотидов, таких как AMP и CTP. Если производится слишком много одной из этих молекул, глутаминсинтетаза чувствует это и немного замедляет производство. Но по мере того, как уровни всех этих нуклеотидов и аминокислот повышаются, вместе они все больше и больше замедляют глутаминсинтетазу. В конце концов, фермент останавливается, когда предложение удовлетворяет спрос.
Если производится слишком много одной из этих молекул, глутаминсинтетаза чувствует это и немного замедляет производство. Но по мере того, как уровни всех этих нуклеотидов и аминокислот повышаются, вместе они все больше и больше замедляют глутаминсинтетазу. В конце концов, фермент останавливается, когда предложение удовлетворяет спрос.
Связь между многими активными сайтами
Показанная здесь молекула глутаминсинтетазы (запись PDB 1fpy ) получена из бактерий. Он состоит из двенадцати идентичных субъединиц, каждая из которых имеет активный центр выработки глутамина. При проведении реакции активный центр связывается с глутаматом и аммиаком, а также с молекулой АТФ, которая запускает реакцию. Но активные центры также слабо связываются с другими аминокислотами и нуклеотидами, частично блокируя действие фермента. Все многочисленные сайты взаимодействуют друг с другом, и по мере роста концентрации конкурирующих молекул блокируется все больше и больше сайтов, что в конечном итоге приводит к отключению всего фермента. У клетки есть более прямой подход, когда она хочет выключить фермент. В ключевом тирозине рядом с активным центром, отмеченном здесь желтым цветом и показанным стрелкой, молекула АДФ может быть присоединена к белку, полностью блокируя его действие.
У клетки есть более прямой подход, когда она хочет выключить фермент. В ключевом тирозине рядом с активным центром, отмеченном здесь желтым цветом и показанным стрелкой, молекула АДФ может быть присоединена к белку, полностью блокируя его действие.
Отсутствие контроля
Мы производим несколько версий глутаминсинтетазы в наших собственных клетках. Большинство наших клеток образуют версию, подобную показанной здесь бактериальной, но с восемью субъединицами вместо двенадцати. Подобно бактериальному ферменту, он контролируется богатыми азотом соединениями в синтетическом конвейере. Мы также производим вторую глутаминсинтетазу в нашем мозгу. Там глутамат используется в качестве нейротрансмиттера, а глутаминсинтетаза используется, когда глутамат рециркулирует после подачи нервного импульса. В головном мозге глутаминсинтетаза находится в постоянном действии, поэтому строго регулируемая версия не подходит. Вместо этого альтернативная форма активна все время, постоянно выполняя свою основную функцию.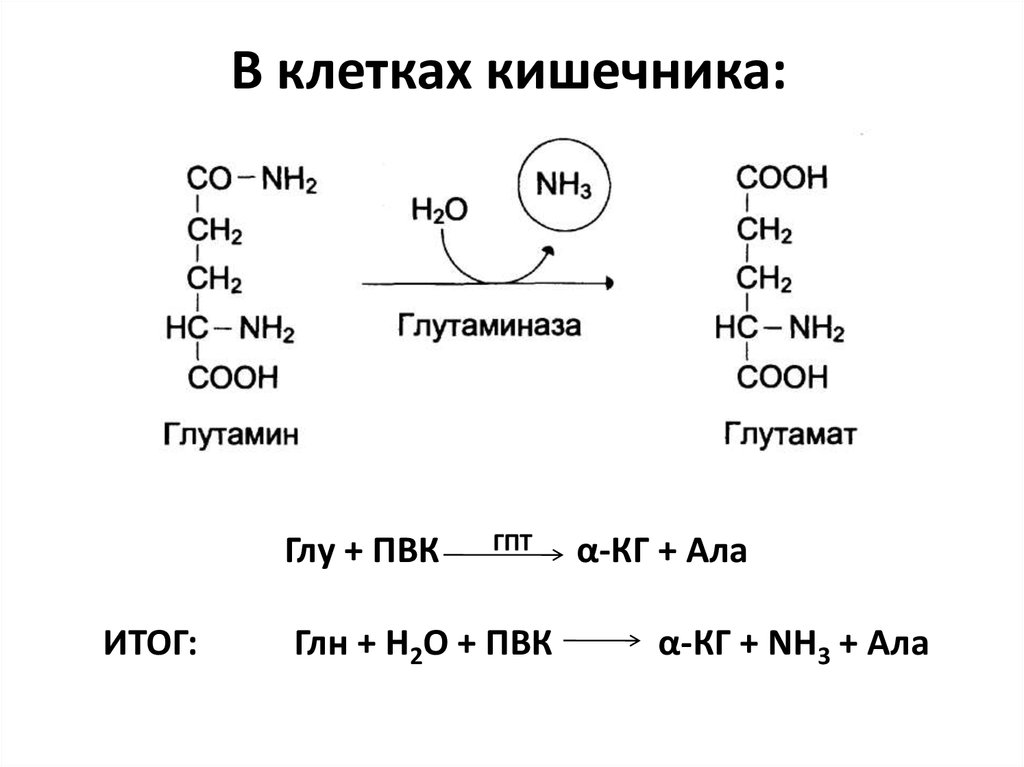
Активные центры глутаминсинтетазы.
Загрузить изображение в формате TIFF в высоком качестве
Two Doors
В каждом из двенадцати активных участков глутаминсинтетазы есть два иона металла, либо магния, либо марганца (показаны здесь фиолетовым), связанные в центре туннеля. Субстраты входят с двух сторон туннеля: АТФ входит на открытые грани сверху и снизу фермента (АТФ хорошо видна на верхнем рисунке на предыдущей странице), а глутамат и аммиак выдавливаются через отверстие между верхним кольцом. субъединиц и нижнего кольца. Эта структура, запись PDB 1fpy , содержит молекулу АДФ, связанную в месте АТФ, два иона марганца (которые связываются прочнее, чем магний, но замедляют работу фермента) и ингибитор, который примерно такого же размера и формы, как глютамин.
Изучение структуры
Глутаминсинтетаза — огромный фермент. Запись PDB 2gls — хорошее место для начала изучения структуры.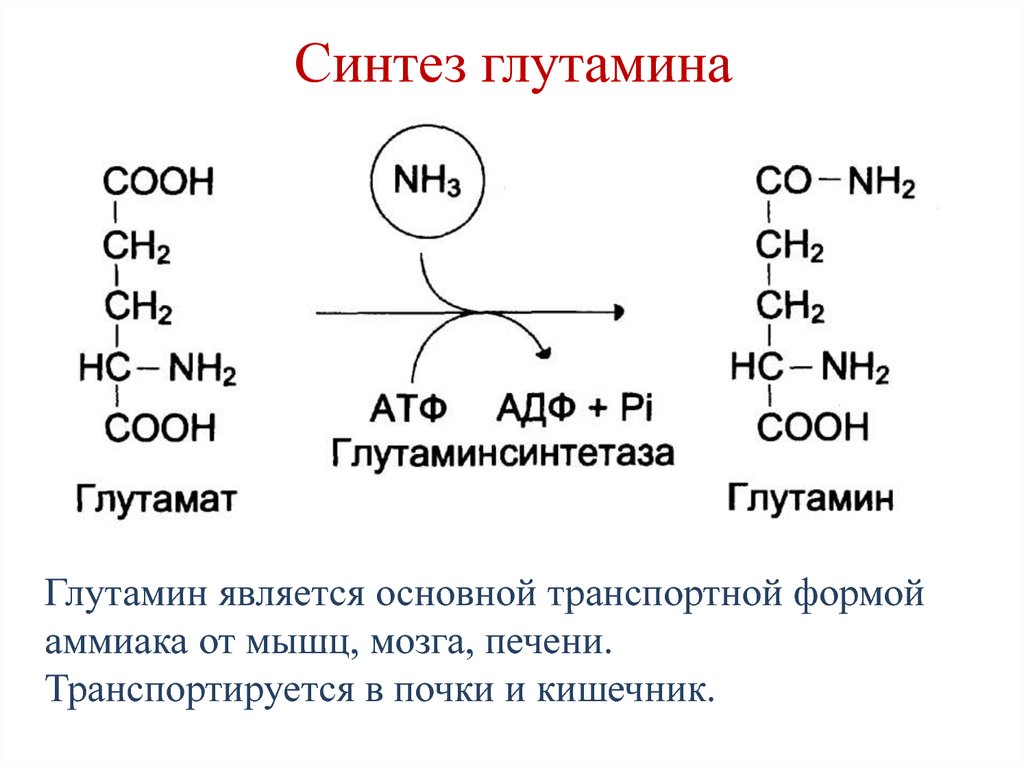 Попробуйте использовать базовую диаграмму, подобную той, что показана здесь, чтобы показать взаимодействие между субъединицами. Поскольку регуляция глутаминсинтетазы зависит от связи между субъединицами, субъединицы тесно связаны друг с другом. Конец каждой цепи вплетается в середину соседней субъединицы в противоположном кольце — обратите внимание, как субъединица, окрашенная в красный цвет, впивается в синюю субъединицу.
Попробуйте использовать базовую диаграмму, подобную той, что показана здесь, чтобы показать взаимодействие между субъединицами. Поскольку регуляция глутаминсинтетазы зависит от связи между субъединицами, субъединицы тесно связаны друг с другом. Конец каждой цепи вплетается в середину соседней субъединицы в противоположном кольце — обратите внимание, как субъединица, окрашенная в красный цвет, впивается в синюю субъединицу.
Эта иллюстрация была создана с помощью RasMol. Вы можете создавать подобные иллюстрации, нажимая на коды доступа и выбирая один из вариантов 3D-просмотра.
Ссылки
- Дэвид С. Айзенберг, Хариндарпал С. Гилл, Гастон М.У. Pfluegl и Sergio H. Rothstein (2000): Структурно-функциональные отношения глутаминсинтетаз. Biochimica et Biophysica Acta 1477 , стр. 122-145.
Июнь 2002 г., Дэвид Гудселл
doi:10.2210/rcsb_pdb/mom_2002_6
О PDB-101
PDB-101 помогает преподавателям, студентам и широкой публике исследовать трехмерный мир белков и нуклеиновых кислот.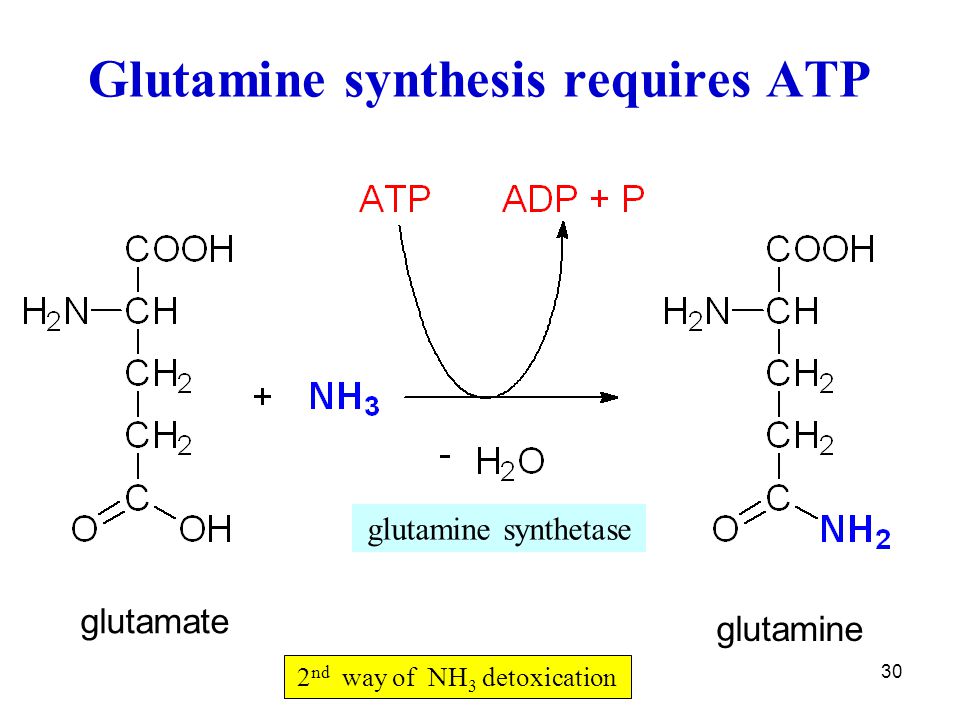
 Часть I: Приобретено
Часть I: Приобретено Методы очистки биологических
Методы очистки биологических Группы характеристик
Группы характеристик