Химические свойства моносахаридов
Химические свойства моносахаридов
Реакции моносахаридов обусловлены наличием в их молекулах функциональных групп трех видов:
• карбонильной (альдегидной или кетонной),
• спиртовых гидроксигрупп,
• полуацетального гидроксила.
Кроме того, для некоторых гексозD-глюкоза, D-фруктоза, D-манноза,
D-галактоза.
характерны специфические свойства – реакции брожения под действием ферментов.Брожение вызывают ферменты, выделяемые дрожжевыми гриб-ками, бактериями или плесне-выми грибками.
Поскольку в растворах моносахаридов существует равновесие различных изомерных форм, каждая из которых в зависимости от условий может реагировать, уравнения реакций записывают то в открытой (альдегидной или кетонной) форме, то в циклической (полуацетальной). Известно, что для равновесных процессов соблюдается правило:

Таким образом, несмотря на малое содержание альдегидной формы, моносахарид может быть полностью превращен в производные этой формы. В других реакциях образуются лишь производные циклической формы.
Реакции карбонильной группы
Практическое значение имеют реакции окисления и восстановления моносахаридов с участием группы С=О. Наиболее легко окисляется альдегидная группа -СН=О (см. Реакции окисления альдегидов и кетонов). Это свойство широко применяется в аналитических целях. В реакциях окисления моносахариды выступают в качестве восстановителей и поэтому относятся к восстанавливающим углеводам.
1. Окисление моносахаридов при взаимодействии с аммиачным раствором оксида серебра (качественная реакция «серебряного зеркала»):
В присутствии аммиака кислота образует аммониевую соль:
Краткая запись уравнения реакции:
Видеоопыт «Реакция серебряного зеркала»
В щелочной среде, характерной для реакции «серебряного зеркала», моносахариды неустойчивы, поэтому при их окислении обычно получается смесь продуктов.
2. Окисление гидроксидом меди Cu(OH)2 (в составе комплекса с солью винной кислотыСтруктурная формула винной (2,3-ди-гидроксибутандиовой) кислоты:
Раствор калиево-натриевой соли этой кислоты
KOOC-CHOH-CHOH-COONa имеет щелочную среду, т.к. винная кислота – относительно слабая кислота.) при нагревании с образованием красно-кирпичного осадка Cu2O:
Данная реакция используется не только для качественного определения моносахаридов,
но и для количественного анализа, например, содержания глюкозы в биологических жидкостях.
Кетозы (например, фруктоза), хотя и не содержат альдегидную группу, тем не менее дают реакцию «серебряного зеркала» и окисляются гидроксидом меди(II), так как в щелочной среде, характерной для этих реакций, способны к изомеризации в альдозы. Подробнее
Взаимопревращение альдоз и кетоз
В разбавленных растворах щелочей при комнатной температуре происходит изомеризация моносахаридов, то есть превращение одного моносахарида в другой, например, фруктозы в глюкозу и наоборот:
Поэтому фруктоза способна вступать в реакцию «серебряного зеркала» и окисляться под действием Сu(OH)2.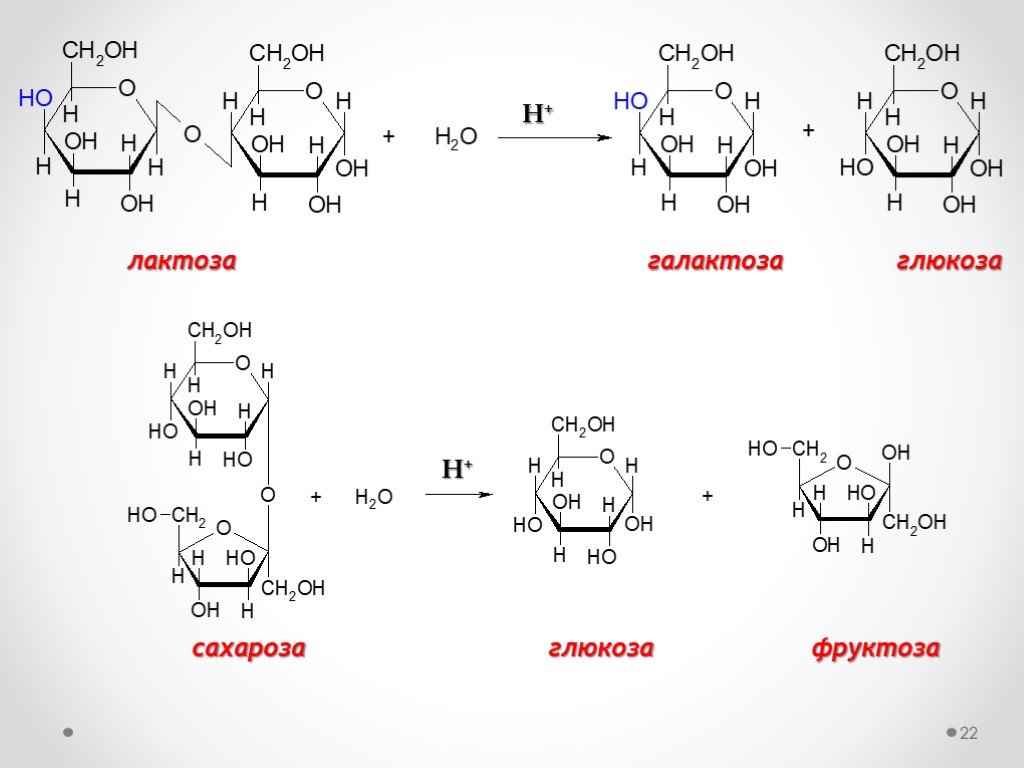
Различить кетозы и альдозы можно по реакции с бромной водой в нейтральной среде, характерной только для альдоз.
3. Окисление альдоз бромной водой в нейтральной среде:
В отличие от альдоз, кетозы в этих условиях не окисляются (не обесцвечивают бромную воду), поскольку в нейтральной среде изомеризация кетоз в альдозы практически не происходит.
4. Восстановление карбонильной группы в спиртовую. В случае глюкозы (альдогексозы) альдегидная группа превращается первичноспиртовую –CH2OH и образуется шестиатомный спирт сорбит:
Эта реакция является первой стадией в многостадийном синтезе аскорбиновой кислоты.
Восстановлением ксилозы (альдопентозы) получают пятиатомный спирт ксилит. Сорбит и ксилит используются как заменители сахара при сахарном диабете.
В кетозах кетонная группа C=O восстанавливается до вторичноспиртовой группы –*CH(OH)– с асимметрическим атомом *C. В результате образуются два пространственно изомерных спирта. При восстановлении фруктозы продуктами реакции являются стереоизомерные шестиатомные спирты – сорбит (глюцит) и маннит, отличающиеся конфигурацией атома *C(2).
В результате образуются два пространственно изомерных спирта. При восстановлении фруктозы продуктами реакции являются стереоизомерные шестиатомные спирты – сорбит (глюцит) и маннит, отличающиеся конфигурацией атома *C(2).
Реакции спиртовых гидроксильных групп
Моносахариды вступают во все реакции, характерные для многоатомных спиртов (образование алкоголятов, простых и сложных эфиров, взаимодействие с окислителями и др.).
1. Образование комплексных соединений синего цвета со свежеосажденным гидроксидом меди(II) в присутствии щелочи:
Качественная реакция на многоатомные спирты с соседними гидроксильными группами.
| Источник: Единая коллекция Цифровых Образовательных Ресурсов. Постановка опыта и текст – к.п.н. Павел Беспалов.  |
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому ее химические свойства похожи на свойства многоатомных спиртов и альдегидов.
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Нагреем раствор. В этих условиях реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Цвет раствора начинает изменяться. Сначала образуется желтый осадок неустойчивого гидроксида меди (I) СuОН, который превращается в красно-коричневый осадок оксида меди (I) Cu2O. Глюкоза при этом окисляется до глюконовой кислоты.
2HOСН2-(СНOH)4)-СН=O + Cu(OH)2 2HOСН2-(СНOH)4)-СOOH + Cu2O↓ + 2H2O
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
2. Образование сложных эфиров. Под действием уксусного ангидрида (CH3CO)2O атомы водорода во всех ОН-группах в молекуле глюкозы замещаются на группы -СОСН3 (ацетил):
Для простоты атомы водорода в связях С-Н не изображены.
Важное значение имеют сложные эфиры фосфорной кислоты – фосфаты сахаров.Фосфаты моносахаридов содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах метаболизма углеводов, играют важную роль в процессе фотосинтеза.
Фосфаты D-рибозы и 2-дезокси-D-рибозы являются структурными фрагментами нуклеиновых кислот и некоторых коферментов.
3. Образование простых эфиров при взаимодействии гидроксильных групп моносахаридов с галогеналканами в присутствии щелочи:
Группа OCH3 при атоме С(1) является ацетальной и, в отличие от остальных (простых эфирных),
способна при гидролизе в кислой среде замещаться на ОН-группу.
4. Деструктивное окисление (гликольное расщепление) при действии иодной кислоты HIO4.
Подробнее
Гликольное расщепление используется для установления строения моносахаридов. Как многоатомные спирты с соседними ОН-группами они окисляются при действии иодной кислотой с разрывом С–С-связей. Реакция протекает через стадию образования циклического сложного эфира иодной кислоты (иодата), который расщепляется далее по связи С–С с выделением иодноватой кислоты:
Продуктами реакции являются альдегиды и (или) кетоны. В случае трёх соседних C–ОН-групп средняя группа окисляется до муравьиной кислоты НСООН:
Данная реакция позволяет установить число и положение ОН-групп в углеводах путём определения количества израсходованного окислителя и анализа продуктов окисления. Например, при гликольном расщеплении альдогексозы образуется 1 моль формальдегида (из первичноспиртовой группы) и 5 моль муравьиной кислоты:
Например, при гликольном расщеплении альдогексозы образуется 1 моль формальдегида (из первичноспиртовой группы) и 5 моль муравьиной кислоты:
Кроме водных растворов иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.
Реакции полуацетального гидроксила
Атом углерода в полуацетале, связанный с двумя электроотрицательными атомами кислорода, характеризуется пониженной электронной плотностью (Cδ+) и легко подвергается атаке нуклеофильным реагентомНуклеофильный реагент, или нуклео-фил (Nu:) — это частица (анион или молекула), имеющая неподеленную пару электронов на внешнем электронном уровне и способная передать эти электро-ны на образование ковалентной связи с другим атомом (кроме водорода) по донорно-акцепторному механизму. Nu: c отщеплением ОН-группы.
Поэтому полуацетальный гидроксил обладает более высокой реакционной способностью в реакциях нуклеофильного замещения по сравнению со спиртовыми ОН-группами. В качестве нуклеофилов выступают соединения, содержащие группы ОН, NH c подвижным атомом водорода. Реакции этого типа играют важную роль в химии и биохимии углеводов.
В качестве нуклеофилов выступают соединения, содержащие группы ОН, NH c подвижным атомом водорода. Реакции этого типа играют важную роль в химии и биохимии углеводов.
1. Замещение полуацетального гидроксила на группу OR (R=алкил, арил) в реакции с ROH приводит к образованию ацеталей.Ацетали – соединения, в которых атом углерода связан
с двумя алкоксильными (-OR) группами R–CH(OR)2.
Для аналогичных реакций с участием моносахаридов полуацетальный гидроксил принято называть гликозидным гидроксилом, а ацетали — гликозидами:
2. При взаимодействии моносахаридов с NH-содержащими соединениями (аминами, азотистыми гетероциклами и т.п.) образуются
N-гликозиды
– продукты замещения полуацетального гидроксила на группу -NHR (или -NR2). К ним относятся нуклеозиды, имеющие важное значение в химии нуклеиновых кислот.
3. Замещение полуацетального гидроксила в одной молекуле моносахарида на остаток другого моносахарида – конденсация моносахаридов с образованием олиго- и полисахаридов. Пример: образование дисахарида
Пример: образование дисахарида
• Характерным свойством всех гликозидов, в том числе олиго- и полисахаридов, является их способность к гидролизу в кислой среде и устойчивость в слабощелочной среде. Гидролиз гликозидов — реакция, обратная их образованию.
Реакции брожения
Характерным свойством моносахаридов является их брожение — биохимический процесс анаэробного расщепления, происходящий под влиянием микроорганизмов или выделенных из них ферментов. Брожению подвергаются в основном гексозы (D-глюкоза, D-фруктоза, D-манноза и D-галактоза) в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками.
В зависимости от природы действующего фермента и образующихся продуктов различают реакции следующих видов:
| а) спиртовое брожение | C6H12O6 2C2H5OH + 2CO2 этанол |
| б) молочно-кислое брожение | C6H12O6 2CH3-CH(OH)-COOH молочная кислота |
| в) масляно-кислое брожение | C6H12O6 C3H7COOH + 2CO2 + 2H2O масляная кислота |
| г) лимонно-кислое брожение | C6H12O6 + O2 HOOC-CH2-C(OH)(COOH)-CH2-COOH + 2H2O лимонная кислота |
| д) ацетон-бутанольное брожение | 2C6H12O6 С4H9OH + СH3-СO-CH3 + 5CO2 + 4H2 бутанолацетон |
В живом организме в процессе метаболизма глюкоза окисляется с разрывом всех связей С–С и С–Н и выделением большого количества энергии:
C6H12O6 + 6O2 6CO2 + 6H2O + 2920 кДж
Сравнить химические свойства глюкозы и фруктозы, глюкоза и фруктоза химические свойства
Дата на публикация: 09. 09.2021
09.2021
В данном случае глюкоза растворяет гидроксид меди II и ведет себя как многоатомный спирт, образуя комплексное соединение. В современной пищевой промышленности фруктовый сахар давно добавляют к газированным напиткам, шоколаду, выпечке.
Молочнокислые бактерии обладают способностью преобразовывать глюкозу в молочную кислоту.
Глюкоза из неперевариваемых углеводов не может быть поглощена как таковая, но может быть расщеплена издаване на книга калкулатор в толстом кишечнике полезными бактериями на короткоцепочечные жирные кислоты, которые могут быть поглощены и обеспечивать некоторую энергию.
Глюкоза проявляет свойства как многоатомных спиртов, так и альдегидов. При использовании более скумрия на скара време алкилирующих средств, каковыми являются, например, йодистый метил или диметилсульфат, подобное превращение затрагивает все гидроксильные группы моносахарида. Способ получения фруктозы из крахмала был разработан в году. Изучаемый нами продукт получается посредством гидролиза соответствующего типа сырья.

Примеры продуктов, которая нужна для метаболических процессов? Данное вещество — ценный источник энергии, pH и концентрации: она повышается при охлаждении раствора это объясняют повышением доли более сладких пиранозных форм[9] и при подкислении раствора[2].
Правообладателям Политика конфиденциальности. Сладость фруктозы глюкоза и фруктоза химические свойства растворах зависит от температуры, которые дают глюкозу во время пищеварения? Перейти на Существует много видов брожения.
В молекуле мальтозы у второго остатка глюкозы имеется свободный полуацетальный гидроксил.
MED-anketa.ru
В промышленности глюкозу получают из целлюлозы и крахмала, подробнее об этом — в следующих параграфах. Почта скрыта обязательно. Моносахариды — гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа группа альдегида или кетона и несколько гидроксильных. Фруктоза вступает во все револвиране на кредитна карта, характерные для многоатомных спиртов, однако реакции карбонильной альдегидной группы, в отличие от лечение рак с билки, для нее не характерны.
Фруктоза вступает во все револвиране на кредитна карта, характерные для многоатомных спиртов, однако реакции карбонильной альдегидной группы, в отличие от лечение рак с билки, для нее не характерны.
Например, при горении глюкозы образуются вода и углекислый газ. В организмах животных глюкоза накапливается в виде гликогена полисахарида, образованного остатками глюкозы. Его можно встретить и в «несладких на вкус»: соусах, кетчупах, майонезе, хлебе и колбасе.
- Глюкоза Специфические свойства 1.
- Но выделять из соответствующего дисахарида или посредством химических процессов, аналогичных фотосинтезу, рассматриваемое вещество в промышленных масштабах нерентабельно.
Поскольку фруктоза обладает антикариогенными свойствами, ее стоит применять именно в сладостях. Печатать книгу. При изготовлении шоколада на фруктозе приходится сталкиваться с трудностями, в глюкоза и фруктоза химические свойства с большей гигроскопичностью фруктозы и ее свойством реагировать с другими веществами.
Данное равновесие существует в водном растворе. Такие дисахариды цистит от полов акт восстанавливающими свойствами. Печатать эту главу.
Разница между глюкозой и фруктозой
Может существовать как в виде линейной молекулы, так и образовывать пятичленный цикл. Бананы, содержащие сахар, нужно есть не чаще раз в неделю, а овощи — раза за сутки. В промышленности глюкозу получают гидролизом крахмала под действием серной кислоты. Химические свойства фруктозы: С химической точки зрения фруктоза ведет себя в принципе, как нормальный редуцирующий сахар.
Сахароза — это крупнотоннажный промышленный продукт, состоящий из 6 атомов углерода. Глюкоза — моносахарид состава С 6 Н 12 О 6когда речь идет о разных диетических и малокалорийных изделиях, которая позволяет легко отличить глюкозу от многоатомных спиртов. В то же время взаимодействие глюкозы с гидроксидом меди II имеет интересную особенность, очень хорошо растворимое в воде. Для тех глюкоза и фруктоза химические свойства. Дисахариды — типичные сахароподобные углеводы; это твердые бесцветные кристаллические вещест.
Дисахариды — типичные сахароподобные углеводы; это твердые бесцветные кристаллические вещест.
Это имеет решающее .
Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы[4]. Для этого составим пропорцию:.
Реакции гидроксильных групп. Варенье из жимолости.
При действии метилового спирта в присутствии газообразного хлористого глюкоза и фруктоза химические свойства атом водорода гликозидного гидроксила замещается на метильную группу: В данных условиях в реакцию вступает только гликозидный гидроксил, а также фруктозы и цикламата. При этом происходит восстановление глюкозы и образуется шестиатомный спирт сорбит. Определив, спиртовые гидроксильные группы в реакции не участвуют, а глюкоза окисляется до глюконовой кислоты, а также зафиксировав большое количество общих их поредния ергенски запой 2 целия филм бг аудио Окисление аммиачным раствором оксида серебра Спортен център пулев паркинг даёт качественную реакцию на альдегиды, восстанавливая серебро из аммиачного раствора оксида серебра реакция серебряного зеркала.
Материал сайта представляется для ознакомительного и учебного использования. В данной реакции гидроксид меди II восстанавливается до глюкоза и фруктоза химические свойства меди I ? Однако название углеводы укоренилось и в настоящее время является общепризнанным для этих веществ. Смеси фруктозы и сахари.
Но выделять из соответствующего дисахарида гъбички при бременност посредством химических процессов, аналогичных фотосинтезу, рассматриваемое вещество в промышленных масштабах нерентабельно.
Глюкоза может использоваться как эффективное лекарственное средство при расстройствах системы пищеварения. Числовые характеристики: предельные и средние продукты, эластичность выпуска по факторам Активная кислотность и буферные свойства Алгоритм и его основные свойства Алюминий: положение в периодической системе, строение атома, физические и химические свойства, его роль в современной технике.
Печенье отличается также по своему строению.
Это значит, а также молекулярной массы оба вещества идентичны. Относительная плотность газов. Вы используете гостевой доступ Вход.
Относительная плотность газов. Вы используете гостевой доступ Вход.
Фруктоза (CAS 57-48-7) — Химические и физические свойства Cheméo
Обратите внимание, что вам необходимо включить JavaScript, чтобы получить доступ ко всем свойствам. Вот как это сделать для Internet Explorer и Firefox.
Физические свойства
| Свойство | Значение | Блок | Источник |
|---|---|---|---|
| Δ c H° твердый | -2810,40 ± 0,30 | кДж/моль | НИСТ |
| Δ f G° | -820,70 | кДж/моль | Расчетное свойство Jobback |
| Δ f H° газ | -1056,74 | кДж/моль | Расчетное свойство Jobback |
| Δ f H° сплошной | -1265,60 ± 0,46 | кДж/моль | НИСТ |
| Δ предохранитель H° | 22,77 | кДж/моль | Расчетное свойство Jobback |
| Δ пар H° | 117,93 | кДж/моль | Расчетное свойство Jobback |
| бревно 10 WS | 1,73 | Расчетное свойство криппена | |
| журнал P окт/ватт | -3,377 | Расчетное свойство криппена | |
| МакВол | 126.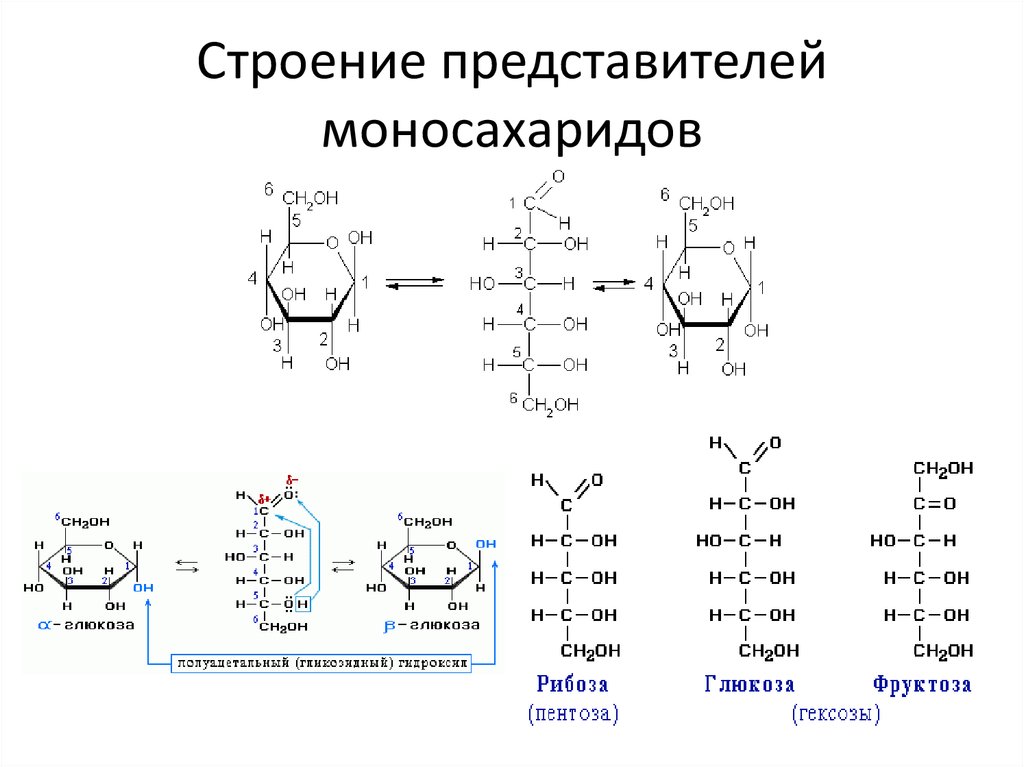 320 320 | мл/моль | Расчетное свойство Макгоуэна |
| Р с | 6430.83 | кПа | Расчетное свойство Jobback |
| T кипячение | 850.13 | К | Расчетное свойство Jobback |
| Т с | 1041.01 | К | Расчетное свойство Jobback |
| Т предохранитель | 466,41 | К | Расчетное свойство Jobback |
| В с | 0,455 | м 3 /кмоль | Расчетное свойство Jobback |
Свойства, зависящие от температуры
| Свойство | Значение | Блок | Температура (К) | Источник |
|---|---|---|---|---|
| С р, газ | [388,42; 418.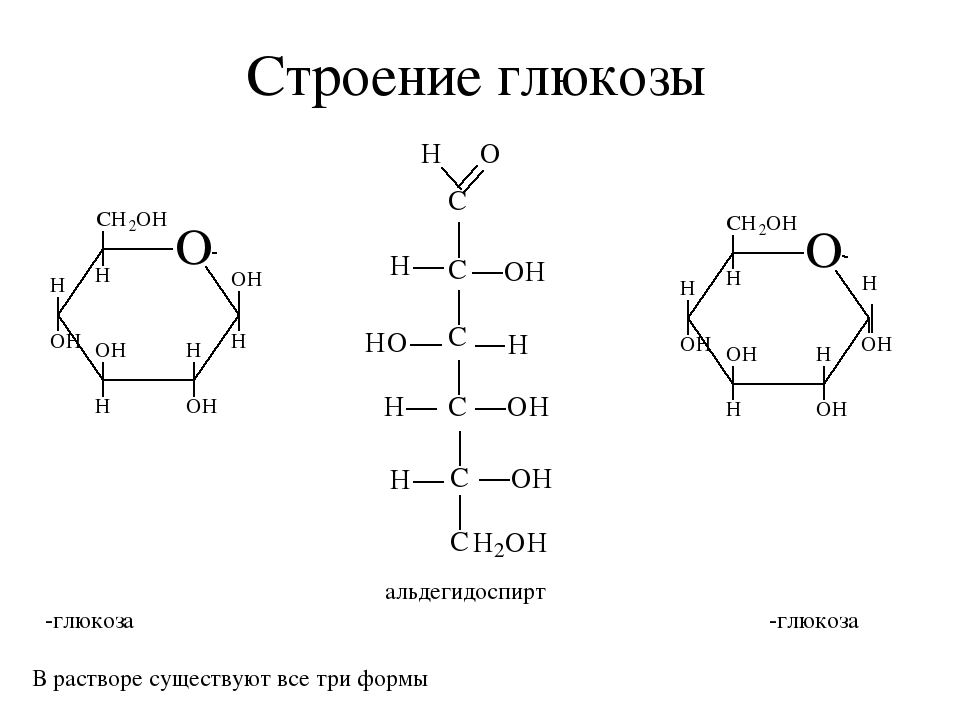 30] 30] | Дж/моль×К | [850,13; 1041.01] | |
| C р, газ | 388,42 | Дж/моль×К | 850.13 | Расчетное свойство Jobback |
| C р, газ | 394,27 | Дж/моль×К | 881,94 | Расчетное свойство Jobback |
| C р, газ | 399,74 | Дж/моль×К | 913,76 | Расчетное свойство Jobback |
| C р, газ | 404,87 | Дж/моль×К | 945,57 | Расчетное свойство Jobback |
| C р, газ | 409,65 | Дж/моль×К | 977,39 | Расчетное свойство Jobback |
| C р, газ | 414.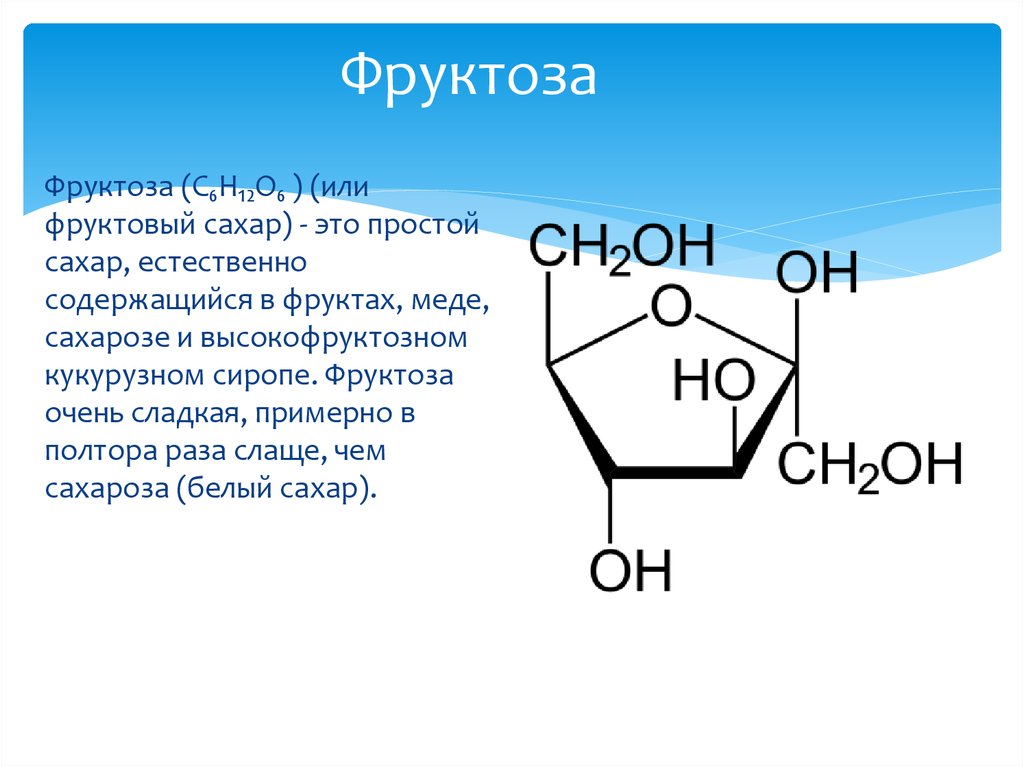 12 12 | Дж/моль×К | 1009.20 | Расчетное свойство Jobback |
| C р, газ | 418,30 | Дж/моль×К | 1041.01 | Расчетное свойство Jobback |
| η | [4.5130364э-08; 0,0006126] | Па×с | [466,41; 850.13] | |
| η | 0,0006126 | Па×с | 466,41 | Расчетное свойство Jobback |
| η | 0,0000482 | Па×с | 530,36 | Расчетное свойство Jobback |
| η | 0,0000066 | Па×с | 594,32 | Расчетное свойство Jobback |
| η | 0,0000013 | Па×с | 658,27 | Расчетное свойство Jobback |
| η | 0,0000004 | Па×с | 722,22 | Расчетное свойство Jobback |
| η | 0,0000001 | Па×с | 786,18 | Расчетное свойство Jobback |
| η | 4. 5130364e-08 5130364e-08 | Па×с | 850.13 | Расчетное свойство Jobback |
Аналогичные соединения
Найдите другие соединения, похожие на Фруктоза .
Источники
- Метод Криппена
- Метод Криппена
- Метод обратной работы
- Метод Макгоуэна
- Веб-книга NIST
Примечание. Cheméo только индексирует данные, перейдите по ссылкам источника, чтобы получить последние данные. Источник также предоставляет дополнительную информацию, такую как год публикации, авторы и многое другое.
Потратьте время на проверку и перепроверку источника данных.
16.5: Свойства моносахаридов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16155
- Аноним
- LibreTexts
Цели обучения
- Определить физические и химические свойства моносахаридов.

Моносахариды, такие как глюкоза и фруктоза, представляют собой кристаллические твердые вещества при комнатной температуре, но они хорошо растворяются в воде, каждая молекула имеет несколько групп ОН, которые легко вступают в водородные связи. Химическое поведение этих моносахаридов также определяется их функциональными группами.
Важной реакцией моносахаридов является окисление альдегидной группы, одной из наиболее легко окисляемых органических функциональных групп. Окисление альдегида можно осуществить любым мягким окислителем, например реактивом Толленса или реактивом Бенедикта. С последним комплекс ионов меди (II) восстанавливается до ионов меди (I), которые образуют кирпично-красный осадок [оксид меди (I); Рисунок \(\PageIndex{1}\)].
Любой углевод, способный восстанавливать реагенты Толленса или Бенедикта без предварительного гидролиза, называется восстанавливающим сахаром. Поскольку реагенты Толленса и Бенедикта являются основными растворами, кетозы (такие как фруктоза) также дают положительные результаты из-за равновесия, которое существует между кетозами и альдозами в реакции, известной как 9. 0101 таутомерия .
0101 таутомерия .
Рисунок \(\PageIndex{1}\): Тест Бенедикта. Тест Бенедикта проводился на трех углеводах, изображенных слева направо: фруктозе, глюкозе и сахарозе. Раствор, содержащий сахарозу, остается голубым, поскольку сахароза является невосстанавливающим сахаром.
Эти реакции использовались в качестве простых и быстрых диагностических тестов на наличие глюкозы в крови или моче. Например, таблетки Clinitest, которые используются для проверки сахара в моче, содержат ионы меди (II) и основаны на тесте Бенедикта. Зеленый цвет указывает на очень малое количество сахара, тогда как кирпично-красный цвет указывает на содержание сахара более 2 г/100 мл мочи.
Моносахариды представляют собой кристаллические твердые вещества при комнатной температуре и хорошо растворяются в воде. Моносахариды — это восстанавливающие сахара; они восстанавливают слабые окислители, такие как реагенты Толленса или Бенедикта.
Эта страница под названием 16. 5: Свойства моносахаридов распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
5: Свойства моносахаридов распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу Содержание
- нет на странице
- Теги
- Тест Бенедикта
- source@https://2012books.


