Содержание
Что такое коллаген?
Термин «коллаген» происходит от греческих слов kolla (клей) и genes (порождающий). Он является компонентом соединительной ткани и присутствует в коже, костях, связках, хрящах, сухожилиях и стенках сосудов. Соединительная ткань выполняет в организме главные защитные и опорные функции, определяя физиологические особенности всех органов и структур. Коллаген, содержащийся в этой ткани, представляет собой белковые нити. Это основной компонент межклеточного вещества, матрикса, заполняющего пространство между клетками и органами.
Зачем он нужен?
Выработка коллагена в коже крайне важна. Именно это вещество способствует сохранению клеток и функциональной связи между ними, а также водно-минеральному обмену. Кожа — орган, в котором содержание этого важного вещества особенно велико — примерно 70% от всех белков. Для различных тканей существуют и разные типы данного вещества.
Именно коллаген, как доказали ученые, помогает тканям восстанавливаться при повреждениях. При этом он имеет очень хорошую совместимость с различными тканями человека, что определяет самый широкий спектр его применения. Коллаген и его производные активно используются в хирургии и стоматологии, трансплантологии и косметологии, а также в других областях медицины.
При этом он имеет очень хорошую совместимость с различными тканями человека, что определяет самый широкий спектр его применения. Коллаген и его производные активно используются в хирургии и стоматологии, трансплантологии и косметологии, а также в других областях медицины.
Чем важен для кожи?
Коллаген по строению напоминает сплетённый из тончайших нитей — микрофибрилл — канат с эластичной и прочной структурой. Тем не менее, с годами, а также под влиянием солнечных лучей, вызывающих фотостарение, коллаген в организме человека (в том числе и в коже) вырабатывается все медленнее, его структура «стареет», ему становится тяжело «держать тонус». В коже это проявляется обвисанием и утратой четкости овала лица, снижением упругости (тургора) кожи и появлением многочисленных морщин и маленьких морщинок.
Чем важен коллаген для кожи?
- Коллаген обладает защитной функцией — придает тканям прочность, защищая от механических повреждений.
- Восстановительные функции коллагена важны для обеспечения клеточной регенерации, образования клеточных оболочек.

- Данный белок является основным тормозящим фактором в развитии меланом.
- Невероятно важен коллаген для кожи потому, что именно он обеспечивает ей тонус, прочность и упругость, играя большую роль в увлажнении. С возрастом его концентрация в тканях уменьшается, потому кожа истончается, теряя прочность и эластичность. По этой причине его и называют белком молодости.
Коллагеновые инъекции
Согласно отзывам врачей, инъекционный коллаген наиболее эффективен. Дело в том, что молекулы крема, содержащего белок, за счет своего крупного размера практически все остаются на поверхности кожи. Коллагеновые инъекции, по многочисленным отзывам — самое действенное средство от морщин. Инъекции пользуются большой популярностью в омоложении кожи, и также корректировки контуров лица. Также, по отзывам косметологов, инъекционный «белок молодости» широко и успешно используют для коррекции шрамов и рубцов различной природы. Такие инъекции способны не только выровнять поверхность кожи и сделать несовершенства менее заметными, но и стимулировать процесс выработки собственного коллагена.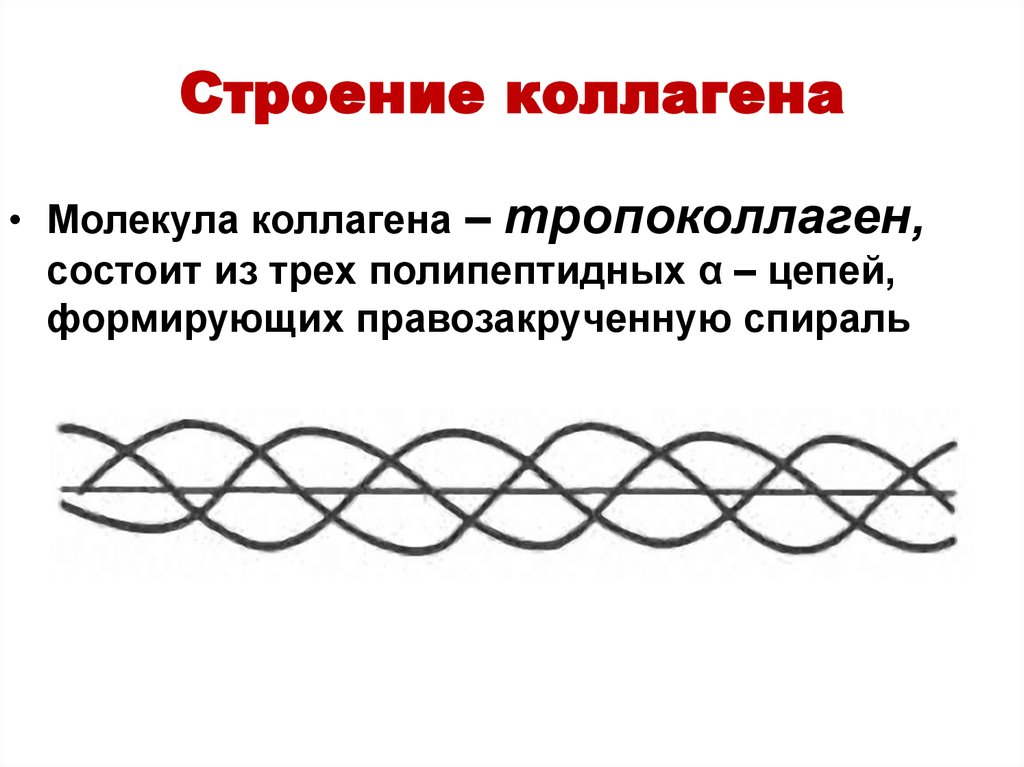
Благодаря своим уникальным свойствам, применяемые в косметических и лечебных целях коллагеновые инъекции для лица давно получили наилучшие отзывы от людей, уделяющих особое внимание своему здоровью и внешнему виду. Этот удивительный белок — уникальный эликсир красоты и молодости, подаренный нам природой.
Коллаген | это… Что такое Коллаген?
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов.[1] Это основной компонент соединительной ткани и самый распространённый протеин у млекопитающих,[2] составляющий от 25% до 35% протеинов во всём теле.
Содержание
|
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известную структуру каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичную структуру молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
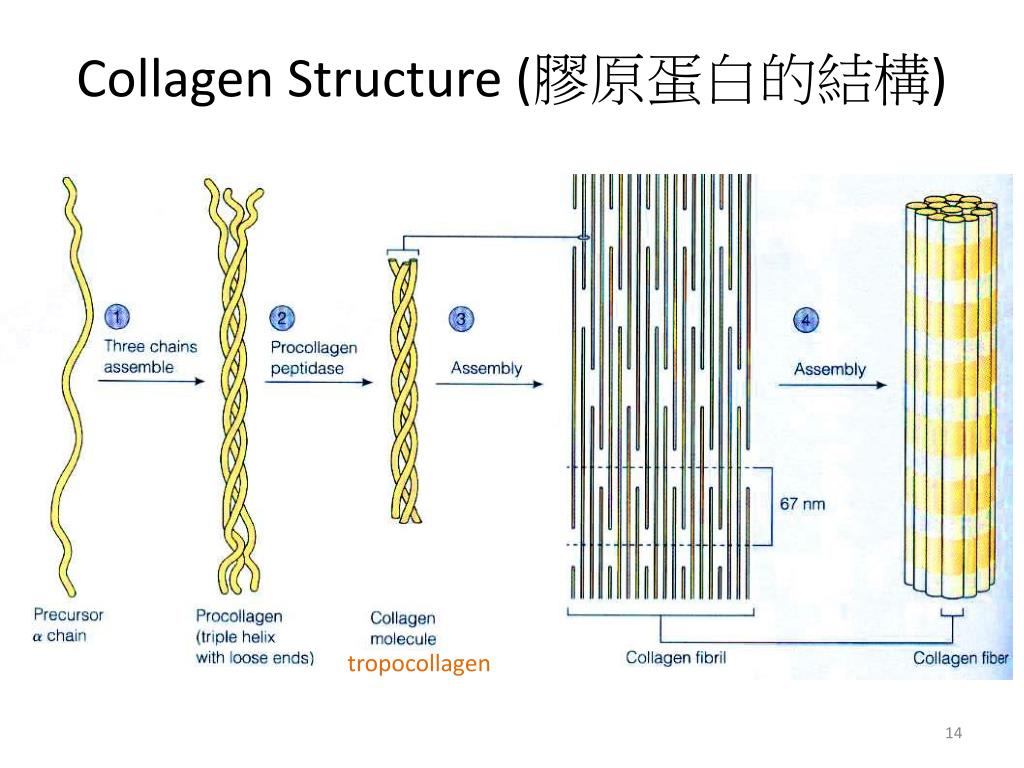
Структура
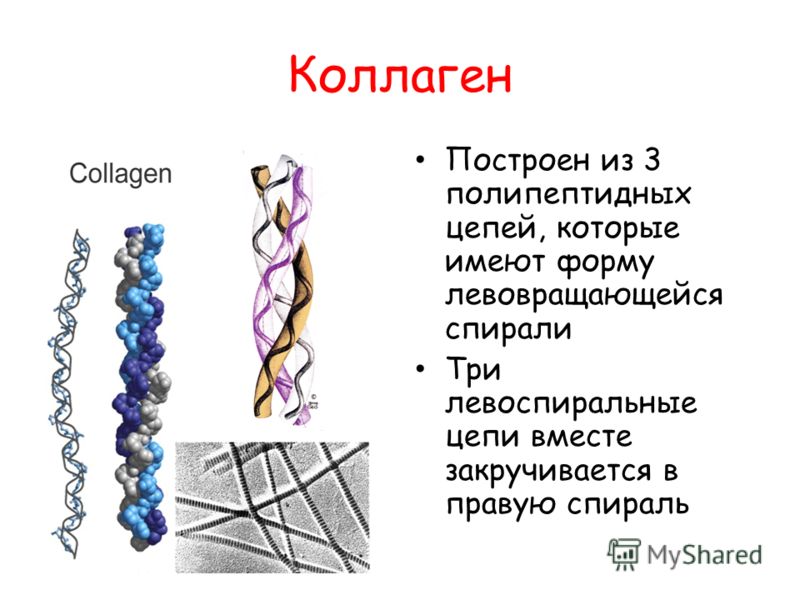
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных треххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлаген (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D -период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D -периода микрофибриллы есть часть, состоящая из пяти молекул называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв».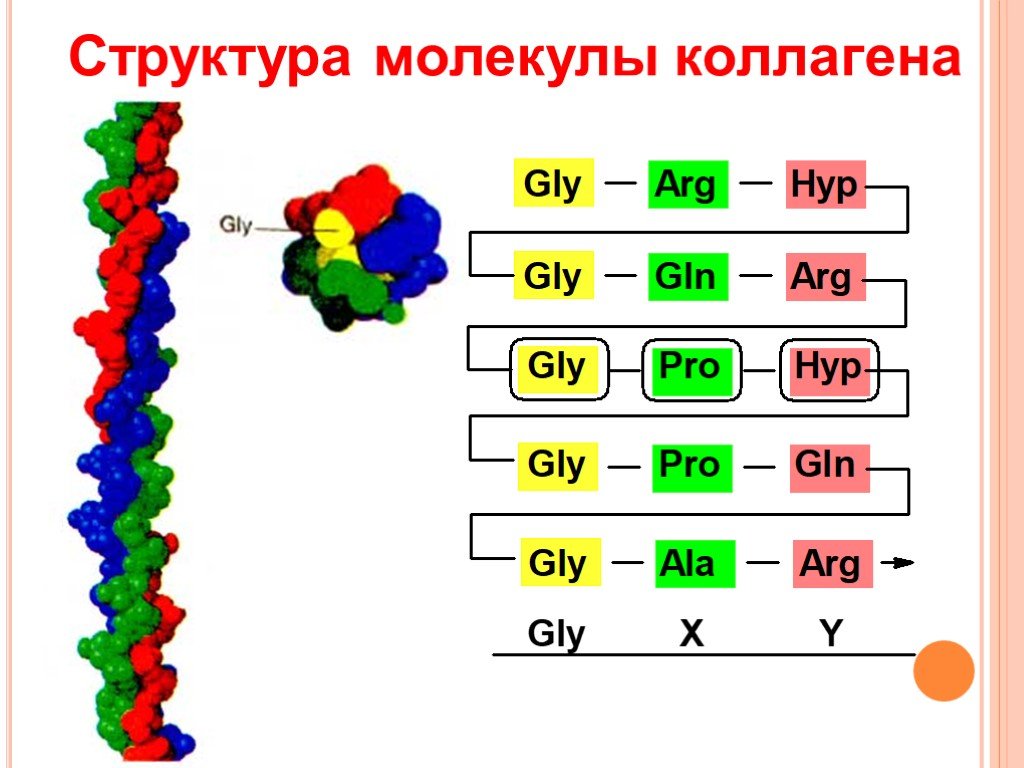 Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершествование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена.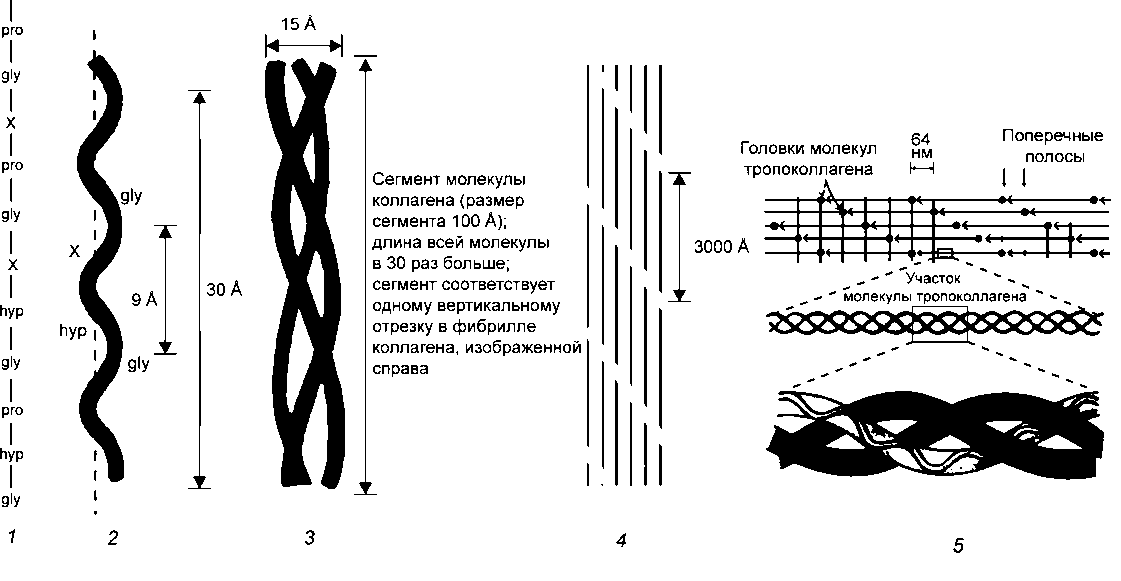 Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов.[источник не указан 928 дней]
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а является лишь частично “переваренными” экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина и разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина и разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые “свободные аминокислоты”. Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму принимающего человека не нужно тратить время, пищеварительные ферменты и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь, и будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование.[источник не указан 664 дня]
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающго слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Пролонгирования действия экстрактов, масел и др.
 в составе косметических композиций;
в составе косметических композиций; - Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена- гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги.
Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена- гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги.
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме белков коллагенов существует множество белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, они не позиционируются как коллагены, а только как «коллагено-подобные». К большой группе коллагено-подобных белков относятся подкомпонент C1q комплемента, C1q подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
И, тем не менее, они не позиционируются как коллагены, а только как «коллагено-подобные». К большой группе коллагено-подобных белков относятся подкомпонент C1q комплемента, C1q подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Хрящи, стекловидное тело, межпозвоночные диски | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Мягкие ткани и полые органы | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Прикрепительные фибриллы в связке кожи и эпидермия | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидно тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпительные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врожденный рахит, врожденная ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, приводящей к изменению формы коллагеновой молекулы, или ошибки в пострансляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация, ведет к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/делеции аминокислоты или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведет к утрате функций. Мутантные a-цепи способны образовывать трех-спиральный комплекс с нормальными a-цепями. В большинстве случаев, такие комплексы не стабильны и быстро разрушаются, однако такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в коллагеновых генах, являются доминантными.
Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/делеции аминокислоты или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведет к утрате функций. Мутантные a-цепи способны образовывать трех-спиральный комплекс с нормальными a-цепями. В большинстве случаев, такие комплексы не стабильны и быстро разрушаются, однако такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в коллагеновых генах, являются доминантными.
Примечания
- ↑ Fibrillar collagen: the key to vertebrate evolution? A tale of molecular incest. Boot-Handford RP, Tuckwell DS. Bioessays. 2003 Feb;25(2):142-51.
- ↑ Di Lullo, Gloria A. (2002). «Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen».
 J. Biol. Chem. 277 (6): 4223–4231. DOI:10.1074/jbc.M110709200. PMID 11704682.
J. Biol. Chem. 277 (6): 4223–4231. DOI:10.1074/jbc.M110709200. PMID 11704682. - ↑ 1 2 Тропоколлаген (Tropocollagen) в словаре dic.academic.ru
- ↑ XuMuK.ru — КОЛЛАГЕН — Химическая энциклопедия
- ↑ Би-би-си | Наука и техника | Найдены мягкие ткани тираннозавра? — 25 марта 2005 г.
- ↑ Элементы — новости науки: Коллаген из костей динозавров — это уже реальность. — 20.04.07
- ↑ Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology. J Biol Chem. 2005 Feb 11;280(6):4005-8.
- ↑ Hoppe HJ, Reid KB. Collectins—soluble proteins containing collagenous regions and lectin domains—and their roles in innate immunity. Protein Sci. 1994 Aug;3(8):1143-58
Ссылки
- Коллаген — статья из Большой советской энциклопедии
- Наследственные коллагенопатии, учебный фильм
- Все про коллаген.
 Любительский сайт
Любительский сайт
Коллагеновая структура: новые трюки от очень старой собаки | Биохимический журнал
Пропустить пункт назначения
Обзорная статья|
08 апреля 2016 г.
Джорди Белла
Biochem J (2016) 473 (8): 1001–1025.
https://doi.org/10.1042/BJ20151169
История статьи
Получено:
16 ноября 2015 г.
Редакция Получено:
25 января 2016 г.
Принято:
01 февраля 2016 г.
Просмотры
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
Делиться
- Твиттер
- MailTo
Иконка Цитировать
ЦитироватьПолучить разрешения
Цитата
Джорди Белла; Коллагеновая структура: новые трюки от очень старой собаки. Biochem J 15 апреля 2016 г.; 473 (8): 1001–1025. doi: https://doi.org/10.1042/BJ20151169
Biochem J 15 апреля 2016 г.; 473 (8): 1001–1025. doi: https://doi.org/10.1042/BJ20151169
Скачать файл цитаты:
- Ris (Zotero)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Документы
- Конечная примечание
- РефВоркс
- Бибтекс
панель инструментов поиска
Расширенный поиск
Основные черты тройной спиральной структуры коллагена были установлены в середине 1950-х годов на основе рентгеновской дифракции волокон сухожилий. Тем не менее, полученные модели могли предложить только среднее описание молекулярной конформации. Критический прогресс произошел примерно 20 лет спустя с химическим синтезом достаточно длинных и гомогенных пептидов с последовательностями, подобными коллагену. Наличие этих модельных пептидов коллагена привело к большому количеству биохимических, кристаллографических и ЯМР-исследований, которые произвели революцию в нашем понимании структуры коллагена. Кристаллические структуры высокого разрешения из пептидов модели коллагена предоставили множество данных о конформационной изменчивости коллагена, взаимодействии с водой, стабильности коллагена или эффектах прерываний. Кроме того, значительное увеличение количества структур пептидов модели коллагена в комплексе с доменами рецепторов или белков, связывающих коллаген, пролило свет на механизмы распознавания коллагена. В последние годы биохимия коллагена вышла за границы естественных последовательностей коллагена. Подробное знание структуры коллагена открыло поле для инженеров-белков, которые использовали подходы химической биологии для получения гиперстабильных коллагенов с неестественными остатками, рационально разработанных гетеротримеров коллагена, самособирающихся пептидов коллагена и т. д. В этом обзоре обобщены наши текущие представления о структуре коллагена. домен тройной спирали коллагена (COL×3) и дает обзор некоторых новых разработок в области молекулярной инженерии коллагена, направленных на создание новых материалов на основе коллагена с превосходными свойствами.
Кристаллические структуры высокого разрешения из пептидов модели коллагена предоставили множество данных о конформационной изменчивости коллагена, взаимодействии с водой, стабильности коллагена или эффектах прерываний. Кроме того, значительное увеличение количества структур пептидов модели коллагена в комплексе с доменами рецепторов или белков, связывающих коллаген, пролило свет на механизмы распознавания коллагена. В последние годы биохимия коллагена вышла за границы естественных последовательностей коллагена. Подробное знание структуры коллагена открыло поле для инженеров-белков, которые использовали подходы химической биологии для получения гиперстабильных коллагенов с неестественными остатками, рационально разработанных гетеротримеров коллагена, самособирающихся пептидов коллагена и т. д. В этом обзоре обобщены наши текущие представления о структуре коллагена. домен тройной спирали коллагена (COL×3) и дает обзор некоторых новых разработок в области молекулярной инженерии коллагена, направленных на создание новых материалов на основе коллагена с превосходными свойствами.
Ключевые слова:
распознавание коллагена,
стабильность коллагена,
структура коллагена,
водородная связь,
белковый дизайн и разработка
В настоящее время у вас нет доступа к этому содержимому.
У вас еще нет аккаунта? регистр
Получить доступ к этой статье
Что это такое, типы, функции и преимущества
Что такое коллаген?
Коллаген — самый распространенный белок в организме. На его долю приходится около 30% общего белка. Коллаген является основным строительным блоком кожи, мышц, костей, сухожилий, связок и других соединительных тканей вашего тела. Он также содержится в ваших органах, кровеносных сосудах и слизистой оболочке кишечника.
Белки состоят из аминокислот. Основными аминокислотами, образующими коллаген, являются пролин, глицин и гидроксипролин. Эти аминокислоты группируются вместе, образуя белковые фибриллы в виде тройной спирали.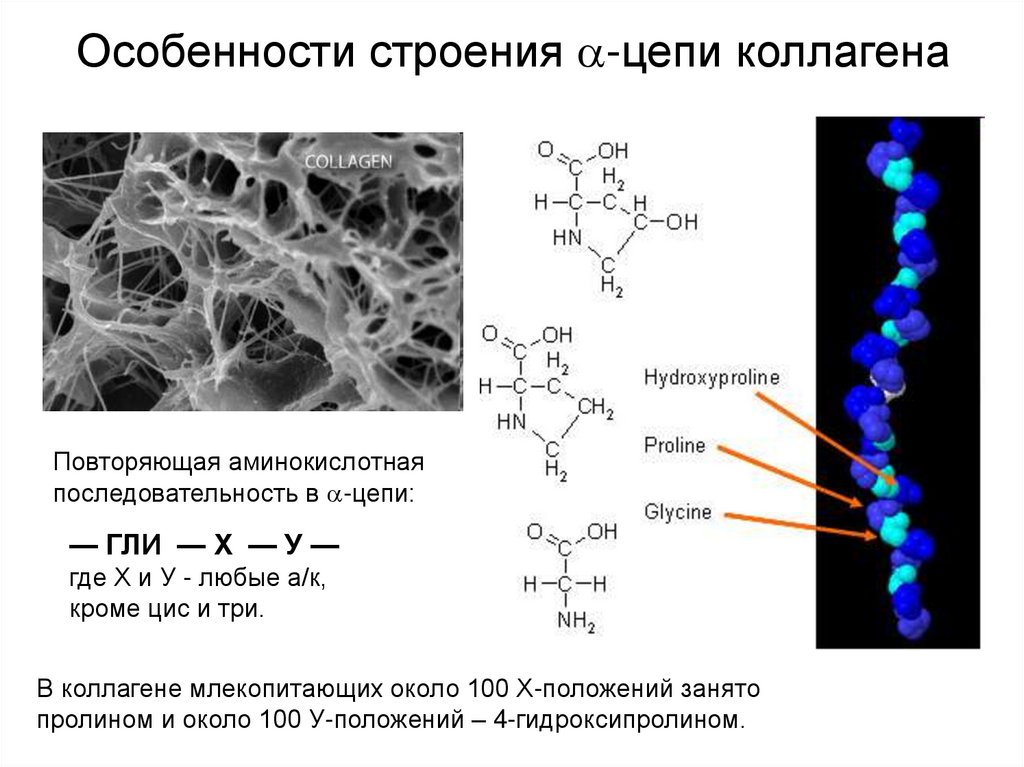 Ваше тело также нуждается в надлежащем количестве витамина С, цинка, меди и марганца, чтобы сделать тройную спираль.
Ваше тело также нуждается в надлежащем количестве витамина С, цинка, меди и марганца, чтобы сделать тройную спираль.
Что делает коллаген?
Основная роль коллагена заключается в обеспечении структуры, силы и поддержки всего тела.
Коллаген выполняет следующие функции:
- Способствует формированию фибробластов в дерме (средний слой кожи), что способствует росту новых клеток.
- Играет роль в замещении омертвевших клеток кожи.
- Обеспечение защитного покрытия органов.
- Придание структуры, силы и эластичности вашей коже.
- Помогает свертываться крови.
Существуют ли разные типы коллагена?
Было идентифицировано около 28 типов типов коллагена. Они различаются тем, как собираются молекулы, добавляются клеточные компоненты и где коллаген используется в организме. Все коллагеновые фибриллы имеют по крайней мере одну структуру тройной спирали.
Основные пять типов коллагена и то, что они делают:
- Тип I.
 Этот тип составляет 90% коллагена вашего тела. Тип I плотно упакован и используется для придания структуры коже, костям, сухожилиям и связкам.
Этот тип составляет 90% коллагена вашего тела. Тип I плотно упакован и используется для придания структуры коже, костям, сухожилиям и связкам. - Тип II. Этот тип встречается в эластичном хряще, обеспечивающем поддержку сустава.
- Тип III. Этот тип встречается в мышцах, артериях и органах.
- Тип IV. Этот тип находится в слоях вашей кожи.
- Тип V. Этот тип встречается в роговице глаз, некоторых слоях кожи, волосах и ткани плаценты.
Что происходит с коллагеном с возрастом?
С возрастом организм вырабатывает меньше коллагена, а существующий коллаген расщепляется быстрее. Коллаген также более низкого качества, чем когда вы были моложе. Женщины испытывают значительное снижение выработки коллагена после менопаузы. Для всех нормально испытывать снижение выработки коллагена после 60 лет.
Могу ли я определить, снижается ли уровень коллагена в моем организме?
Коллаген нельзя измерить — например, в анализе крови — но есть признаки того, что уровень коллагена снижается. Эти признаки и симптомы включают:
Эти признаки и симптомы включают:
- Морщинистая, дряблая или дряблая кожа.
- Освящение вокруг глаз и лица.
- Сокращение, ослабление мышц и мышечные боли.
- Более жесткие, менее гибкие сухожилия и связки.
- Боль в суставах или остеоартрит из-за износа хряща.
- Потеря подвижности из-за повреждения или тугоподвижности суставов.
- Проблемы с желудочно-кишечным трактом из-за истончения слизистой оболочки пищеварительного тракта.
- Проблемы с кровотоком.
Какие привычки образа жизни повреждают коллаген?
Снизьте риск повреждения коллагена, избегая этих привычек образа жизни.
Избегайте следующих факторов, которые могут снизить уровень коллагена в организме:
- Курение. Курение снижает выработку коллагена. Он повреждает коллаген и эластин, что приводит к образованию морщин и замедлению заживления ран. Никотин сужает кровеносные сосуды у поверхности кожи, препятствуя доставке кислорода и питательных веществ.

- Употребление слишком большого количества сахара и рафинированных углеводов. Сахар присоединяется к белкам с образованием конечных продуктов гликирования. Эти молекулы повреждают близлежащие белки и делают коллаген слабым, сухим и ломким.
- Воздействие ультрафиолетового света. Слишком много солнечного света снижает выработку коллагена и вызывает более быстрое разрушение коллагена. Ультрафиолетовые солнечные лучи вызывают морщины. Избегайте чрезмерного пребывания на солнце и всегда наносите солнцезащитный крем (SPF 30 и выше), когда находитесь на улице.
Какие заболевания и другие факторы повреждают коллаген?
Аутоиммунные заболевания (иммунная система организма атакует собственные ткани) могут повредить коллаген. Ревматоидный артрит, волчанка, дерматомиозит и склеродермия являются аутоиммунными заболеваниями соединительной ткани, которые, как известно, повреждают коллаген.
Генетические мутации также могут повредить коллаген. Ошибки построения коллагена приводят к таким состояниям, как синдром Элерса-Данлоса и несовершенный остеогенез.
Ошибки построения коллагена приводят к таким состояниям, как синдром Элерса-Данлоса и несовершенный остеогенез.
Уровень коллагена также естественным образом снижается с возрастом.
Что я могу сделать, чтобы уменьшить потерю коллагена кожей и замедлить признаки старения?
Чтобы замедлить старение кожи, наносите солнцезащитный крем каждый день. Воздействие ультрафиолета повреждает коллаген. Используйте продукты с фактором защиты от солнца (SPF) 30 или выше. Носите широкополую шляпу, солнцезащитные очки с защитой от ультрафиолета и легкие рубашки с длинными рукавами и брюки, находясь на улице. Ищите одежду с маркировкой фактора защиты от ультрафиолета для дополнительной защиты. Избегайте соляриев.
Соблюдайте хорошо сбалансированную диету, такую как средиземноморская диета, которая включает овощи, бобовые, цельнозерновые продукты, орехи и фрукты, а также умеренное количество морепродуктов, мяса, птицы, молочных продуктов и яиц.
Как коллаген используется в медицине и косметике?
Коллаген может расщепляться, преобразовываться и снова всасываться в ваше тело. Он имеет широкий спектр применения в медицине и косметике. Коллаген, используемый в медицинских целях, поступает от людей, коров, свиней или овец. Применение включает:
Он имеет широкий спектр применения в медицине и косметике. Коллаген, используемый в медицинских целях, поступает от людей, коров, свиней или овец. Применение включает:
- Кожные наполнители : Инъекции коллагена могут заполнить неглубокие углубления на коже, такие как линии и морщины.
- Перевязочный материал: Коллаген способствует заживлению ран, привлекая к ране новые клетки кожи.
- Пародонтология: Коллаген действует как барьер, предотвращающий превращение быстрорастущей ткани десны в рану на зубе, давая зубным клеткам время, необходимое для регенерации.
- Сосудистое протезирование: Трансплантаты донорской коллагеновой ткани использовались для реконструкции артерий, регенерации периферических нервов и изготовления протезов кровеносных сосудов.
Повышает ли употребление продуктов, богатых коллагеном, уровень коллагена в моем организме?
Коллаген не может усваиваться организмом в целом виде.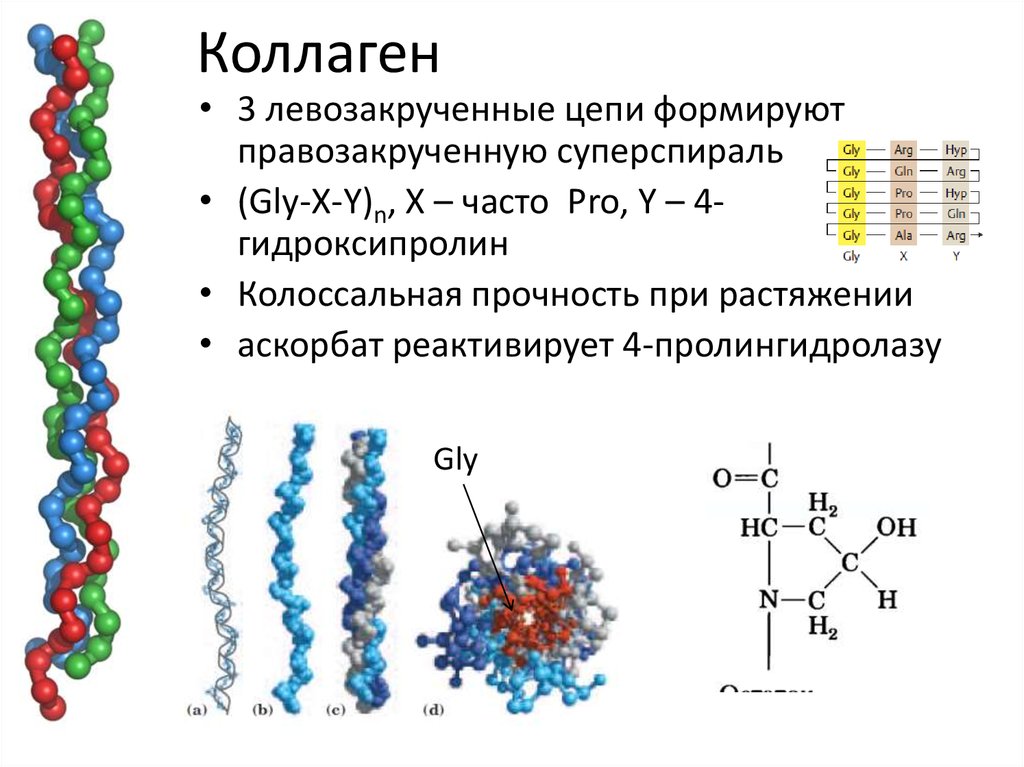 Ваше тело расщепляет белки коллагена, которые вы едите, на аминокислоты. Таким образом, употребление продуктов, богатых коллагеном, не приводит напрямую к повышению уровня коллагена в организме.
Ваше тело расщепляет белки коллагена, которые вы едите, на аминокислоты. Таким образом, употребление продуктов, богатых коллагеном, не приводит напрямую к повышению уровня коллагена в организме.
Тем не менее, многие продукты, содержащие сырые ингредиенты, способствующие выработке коллагена, можно употреблять в пищу как часть здорового питания. Эти продукты содержат аминокислоты пролин и глицин. Витамин С, цинк и медь также необходимы для процесса. Продукты, содержащие эти аминокислоты, витамины и минералы, включают:
- Витамин С. Витамин С содержится в апельсинах, клубнике, болгарском перце, брокколи, брюссельской капусте и картофеле.
- Пролин. Пролин содержится в грибах, капусте, спарже, арахисе, пшенице, рыбе, яичных белках и мясе.
- Глицин. Глицин содержится в красном мясе, индейке, куриной и свиной коже, арахисе и мюслях.
- Медь. Медь содержится в печени, омарах, устрицах, грибах шиитаке, орехах и семенах, зелени, тофу и темном шоколаде.

- Цинк. Цинк содержится в устрицах, красном мясе, птице, свинине, фасоли, нуте, орехах, брокколи, зеленых листовых овощах, цельнозерновых и молочных продуктах.
Что такое коллагеновые пептиды?
Коллагеновые пептиды представляют собой небольшие кусочки животного коллагена. Коллаген не может усваиваться в целом виде. Он должен быть разбит на более мелкие пептиды или аминокислоты. Пероральные добавки коллагена выпускаются в виде таблеток и порошков. Обычно они содержат две или три аминокислоты. Они продаются в виде пептидов коллагена или гидролизованного коллагена. Коллагеновые пептиды всасываются через желудочно-кишечный тракт.
Что говорят исследования об эффективности добавок коллагена?
Недостаточно рандомизированных контролируемых испытаний пищевых добавок (золотой стандарт для проверки эффективности лекарств). Несколько таких исследований показали, что пептиды коллагена, возможно, эффективны для улучшения увлажнения и эластичности кожи.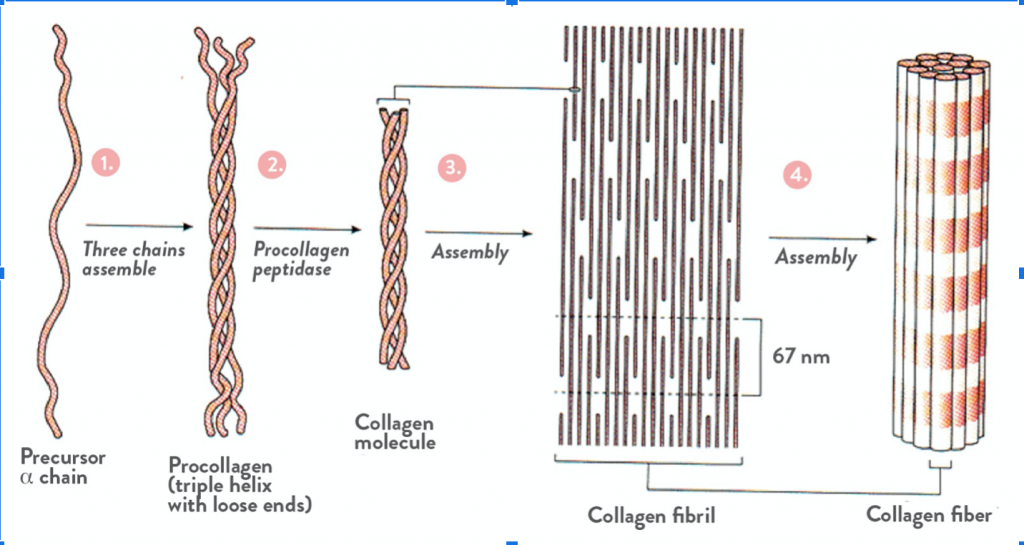 Он также, возможно, эффективен для облегчения боли и улучшения функции суставов у людей с остеоартритом коленного сустава.
Он также, возможно, эффективен для облегчения боли и улучшения функции суставов у людей с остеоартритом коленного сустава.
Важная информация о пищевых добавках:
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не регулирует добавки коллагена. Они не требуют двойных слепых, плацебо-контролируемых, рандомизированных исследований, которые проводят лекарства, чтобы быть одобренными. Производителям добавок не нужно доказывать, что их продукты безопасны или эффективны, прежде чем выводить их на рынок.
- Многие исследования, проводимые с добавками, финансируются индустрией пищевых добавок, или авторы исследования имеют финансовые связи с индустрией пищевых добавок.
- Неизвестно, будут ли коллагеновые добавки делать то, что рекламирует этикетка.
Наконец, имейте в виду, что употребление пептидов коллагена — из пищевых продуктов или добавок — не может быть направлено туда, где вы хотите их использовать.
 1 Пищевая промышленность
1 Пищевая промышленность в составе косметических композиций;
в составе косметических композиций;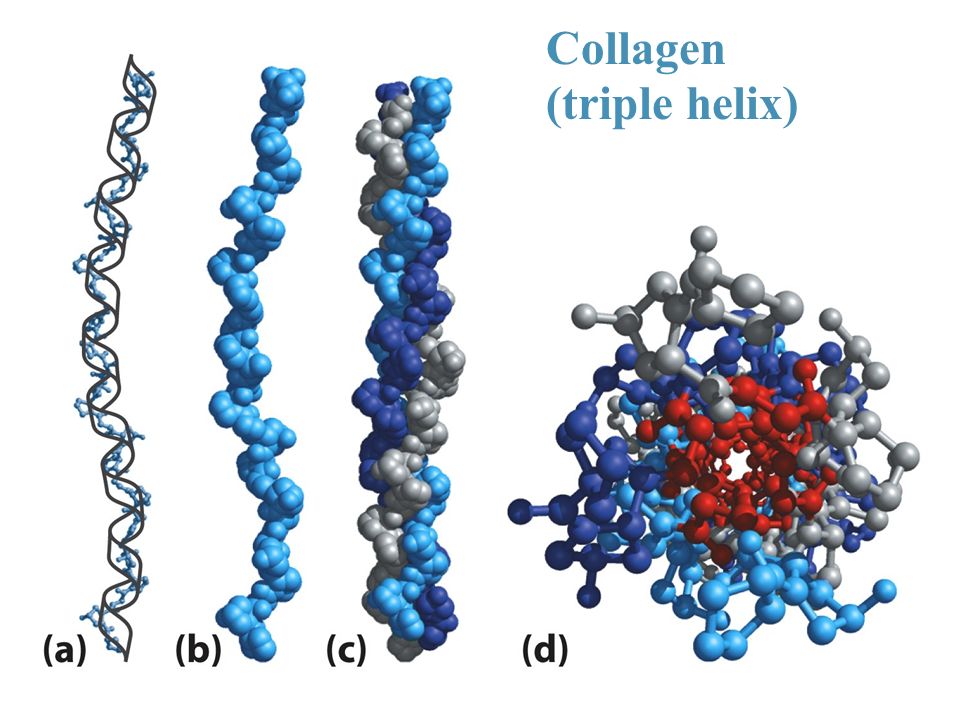 J. Biol. Chem. 277 (6): 4223–4231. DOI:10.1074/jbc.M110709200. PMID 11704682.
J. Biol. Chem. 277 (6): 4223–4231. DOI:10.1074/jbc.M110709200. PMID 11704682. Любительский сайт
Любительский сайт Этот тип составляет 90% коллагена вашего тела. Тип I плотно упакован и используется для придания структуры коже, костям, сухожилиям и связкам.
Этот тип составляет 90% коллагена вашего тела. Тип I плотно упакован и используется для придания структуры коже, костям, сухожилиям и связкам.