строение и функции белка или чего не знала Анжелина Джоли. Какую структуру могут иметь белки в составе мышц и почему
Белки. Вся правда о главном строительном элементе мышц. [Часть 1].
Э-ге-гей, уважаемые! Рад Вас снова приветствовать на страницах проекта “Азбука Бодибилдинга”!
Наконец-то совершилось!
Мы добрались до одной из самых фундаментальных тем, касающихся питания бодибилдеров – белки. Фундаментальных потому, что это основной строительный кирпичик мышц, именно благодаря ему мы и видим (или не видим) тот объем мускулов, которые нам удалось накачать. Сразу скажу, что хоть тема и довольно сложная, но если в ней разобраться вдоль и поперек, то рельефные мышцы – это как минимум Ваш диагноз.
Если копнуть, то в действительности довольно мало начинающих бодибилдеров (да и просто людей, занимающихся в тренажерном зале), обладают всей полнотой знаний относительно белков. Зачастую им только известно, что белки – это хорошо, их надо есть, да и все пожалуй. Мы же с Вами будем последовательно разбираться как в теоретических вопросах – строение и функции, механизмы синтеза белка, так и в практических – как они строят наши мышцы и т.п. В общем, уделим самое пристальное внимание этому важному компоненту в питании бодибилдера и изучим все тонкие тонкости и нюансные нюансы.

Итак, не будем тянуть кота за затягивать, приступаем к рассмотрению теоретических основ: что такое белки, их строение, функции, роль и т.д.
Белки: что это такое и с чем их едят? Введение в теорию.
Начать хотелось бы с небольшого анонса – если Вы еще совсем зеленый в вопросах питания, тогда следующие статьи будут как нельзя кстати: [Пирамида питания. Руководство к применению], [Правильное и здоровое питание. Все, что надо знать].
Я уже ранее говорил, что пища в виде нутриентов (белков, жиров, углеводов, минералов и витаминов) поступает в наш организм. Однако намеренно не акцентировал свое внимание на том, сколько конкретно нужно употреблять этих компонентов, чтобы закрывать поставленные цели, будь то набор мышечной массы или сброс веса. Что ж, пришло время поговорить и об этом.
Итак, самое простое определение белка (с точки зрения его важности) было сформулировано еще Энгельсом, и звучало оно так, жизнь – способ существования белковых тел. Из него сразу понятно, что не будет белка – не будет жизни. Применительно к бодибилдингу можно сказать, что не будет белка – не будет мышц. Теперь окунемся в науку.
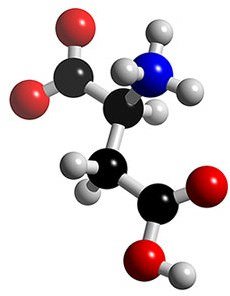
Белок (он же протеин) – это высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. Аминокислотный состав белка полностью определяется 20 аминокислотами (9 - не заменимые/не синтезируются организмом и 11 – заменимые), входящими в его состав.
- Незаменимые: лейцин, изолейцин, валин, гистидин, лицин, метионин, треонин, триптофан, фенилаланин;
- Заменимые: аланин, аргенин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистин.
Примечание:
Гемоглобин – самый известный белок, его химическая формула показывает, насколько это высокомолекулярные вещества – С3032h5816O872N780S8Fe4. Молекулярная масса белков колеблется от нескольких тысяч до нескольких миллионов. Например, Mr белка яйца = 36000, Mr белка мышц = 1500000 (для сравнения, Mr спирта =46).
Помимо этих 20 аминокислот есть еще и те, которые не входят в состав белка, однако выполняют важные функции в организме, например гамма-аминомасляная кислота и диоксифенилаланин участвуют в передаче нервных импульсов и являются важными компонентами нервной системы. Без них процесс тренировок был бы похож на бесконтрольные, амебной формы телодвижения (хотя, может у кого-то и с ними он так выглядит).
Самыми важными для организма (с точки зрения метаболизма) являются такие аминокислоты, как: лейцин, изолейцин и cвалин (см. таблицу).
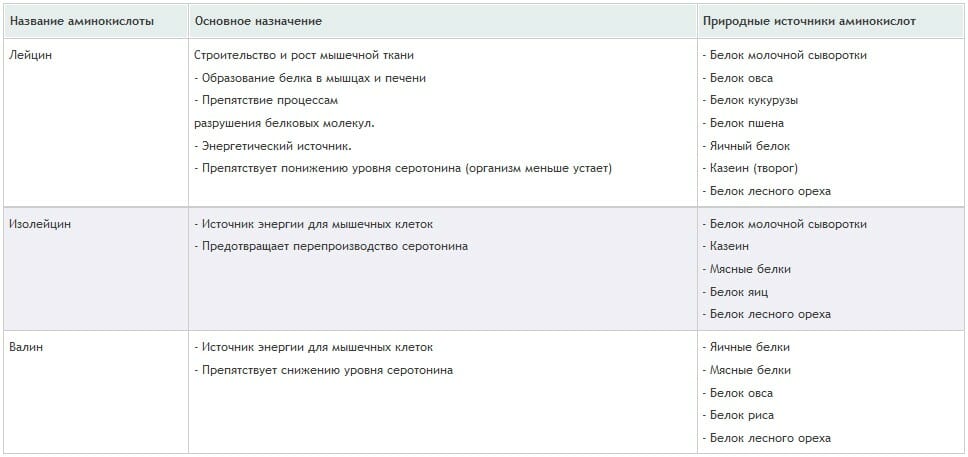
Все три аминокислоты являются представителями так называемого ВСАА-класса (Branched Chain Amino Acids, разветвленная цепь). На долю этого класса из всех незаменимых кислот приходится 42%, что является весьма внушительной цифрой. ВСАА-аминокислоты играют важную роль в белковом обмене и энергетической составляющей работы мышц. Для оптимального протекания процессов синтеза белка все три аминокислоты должны входить в рацион питания (либо посредством натуральных продуктов, либо с пищевыми добавками).
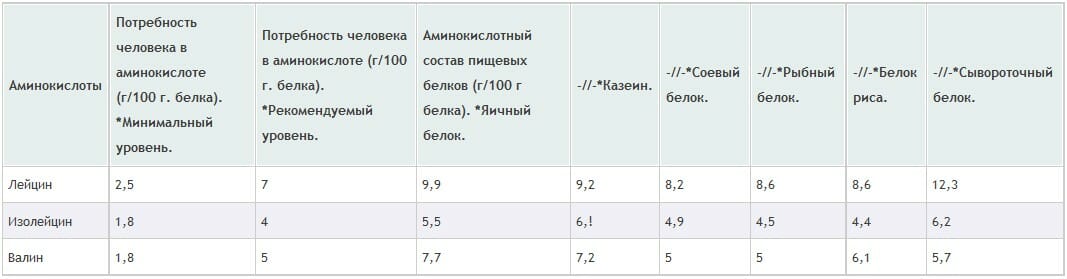
С конкретными цифрами потребления этих трех аминокислот, а также с аминокислотным составом пищевых белков, Вы можете ознакомиться из следующей таблицы (см. таблицу).
Идем далее.
В состав белковых веществ входят такие химические элементы как: углерод, водород, кислород, сера, фосфор и, конечно же, основу составляет азот. В связи с этим, просто необходимо знать (помнить) о таком понятии, как азотистый баланс. Помимо того, что азот (в основном, из белка) поступает к нам с пищей, он также образуется (и выделяется из организма) в процессе обмена веществ из продуктов распада белков. Поэтому наш организм – это станция по переработке (с одной стороны) и выведению (с другой стороны) азота.
Разница между приходом и расходом азота позволяет нам говорить о положительном (потребляем больше, чем выделяем) или отрицательном (наоборот) азотистом балансе. Таким образом, необходимо помнить, что набрать силу и мышечную массу можно только при положительном азотистом балансе.
Примечание:
В зависимости от тренированности атлета для сохранения положительного азотистого баланса необходимо разное потребление белка на 1 кг веса тела атлета. В целом, цифры примерно следующие:
- атлет, бодибилдер со стажем (2-3 год и более) – 2 грамма/кг веса;
- новички (1 год и менее) – 2-3 грамма/кг веса.
Собственно, помимо того, что белок - это основной структурный элемент мышц, он также выполняет множество других функций. Давайте их более подробно рассмотрим.
Функции белков
Конечно, с точки зрения бодибилдинга наибольшее значение представляет строительная функция белков, однако они также выполняют еще много важных и нужных для организма (см. изображение).
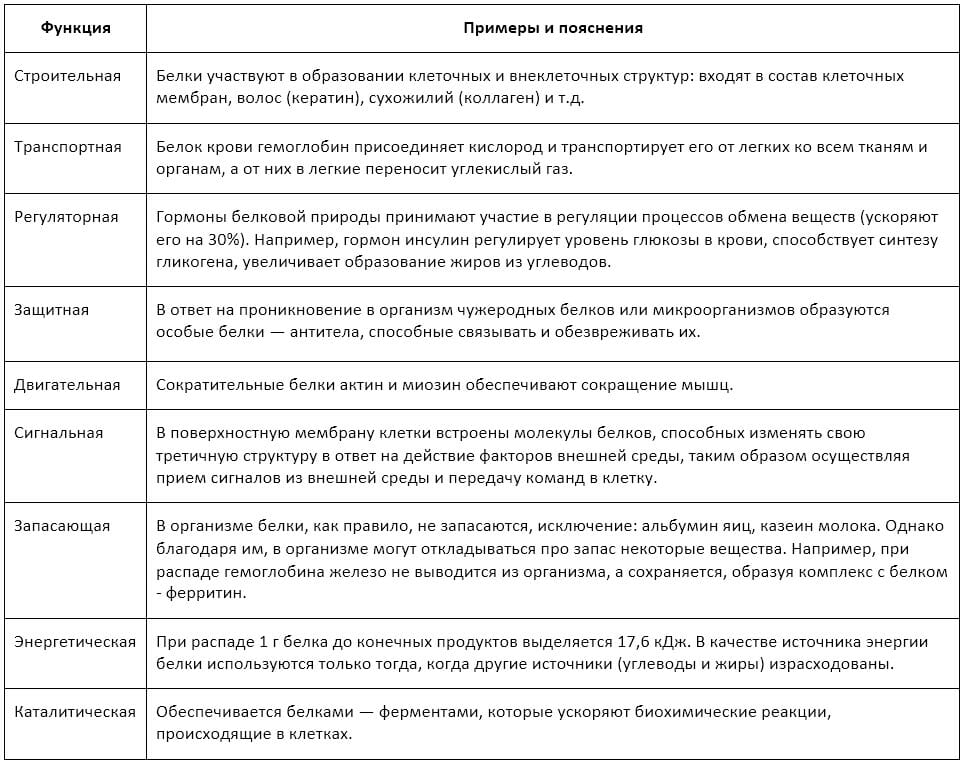
Более наглядно с функциями и ролью белков можно ознакомиться из видео-ролика в конце статьи, так что дочитываем до конца!
Организм человека весьма умная, саморегулирующаяся система. Он заранее знает, что, хоть и белки могут выступать в качестве резервного источника энергии, но расходовать этот высококачественный материал на энергообеспечение нецелесообразно, поэтому использует углеводы. Когда же организм чувствует, что рацион питания спортсмена обеднен углеводами, ему ничего не остается делать, как брать ценный белок и использовать его в качестве источника энергии для подпитки организма. Так что не забывайте про углеводы тоже (о них мы также будем говорить в наших статьях, не пропустите).
Белки по-разному воздействуют на мышцы, это, в первую очередь, обуславливается их различным химическим составом и структурой молекул. Поэтому нужно знать источники высококачественных белков, которые в полном объеме будут строить Ваши мышцы. Здесь важное значение имеет такое понятие как биологическая ценность белка (BV) – это то его количество, которое запасается организмом при употреблении в пищу 100 гр данного белка. Кроме того, если BV=1, то это означает, что продукт содержит полный набор всех незаменимых аминокислот.
Примечание:
Например, куриное (перепелиное) яйцо обладает коэффициентом биологической полноценности (BV) – 1, а вот пшеница – содержит только половину незаменимых кислот (т.е. ее BV = 0,54). Получается, что при одинаковом содержании в продуктах количестве белка (12,7 грамм/100 гр. продукта), организм сможет наиболее полно и в большем объеме усвоить именно из яиц, ибо BV у них выше, чем у пшеницы.
После того, как мы употребили белки (в виде продуктов питания, пищевых добавок), они расщепляются в ЖКТ за счет ферментов до аминокислот, а затем и до конечных продуктов – воды, углекислого газа и аммиака, потом всасываются через стенки кишечника, распределяясь по всему организму, чтобы выполнить свои непосредственные функции.
Какие бывают белки?
Лучше преимущественно потреблять белковую пищу животного происхождения (мясо, рыба, морепродукты и т.п.), ибо она по своему аминокислотному профилю наиболее ценна с точки зрения получения питательных элементов из пищи. Однако не стоит забывать и про растительный белок. В целом, соотношение (только по белку) должно выглядеть примерно так: 70-80% – животного происхождения, 20-30% – растительного.
Белки, по степени усвояемости подразделяются на:
- Быстрые – скорость получения элементарных компонент из пищи высокая. Пример: рыба, яйца, куриная грудка, морепродукты;
- Медленные – наоборот. Пример: творог (“долгоиграющий” белок, на 70% состоит из казеина).
По аминокислотному составу белки бывают:
- Полноценные;
- Неполноценные;
- Простые – состоят только из аминок;
- Сложные – в составе аминокислота + неаминокислотный остаток (комплекс с липидами, углеводами).
По степени растворимости:
- Растворимые (образуют коллоидные растворы) в воде;
- Не растворимые в воде.
Когда говорят о бодибилдинге, под белками подразумевают протеины, высококонцентрированный белок. Наиболее распространенные протеины по способу их получения из продуктов следующие:
- Сывороточный – готовится из молочной сыворотки, обладает наибольшим BV и весьма быстро усваивается;
- Яичный – обладает высоким BV, время всасывания 4-6 часов;
- Казеиновый – самый долгий по усвоению, BV=80%;
- Соевый – снижает уровень холестерина в крови, BV=74%.
Если среди читателей есть вегетарианцы, тогда Вам стоит знать, что все растительные белки (соевый, грибной) – неполноценны по-своему аминокислотному составу. Мясо, молоко, яйца – вот те продукты, которые наиболее полно удовлетворяют требования полноценности содержания в их составе аминокислот. Они (белок молочной сыворотки - лактальбумин) и белок желтка вместе с альбумином (белок яйца) наиболее сбалансированы по своему аминокислотному профилю и лучше всего усваиваются организмом.
Таким образом, зная всю эту информацию, нужно правильно составлять свой рацион питания, чтобы он был сбалансирован по всем основным аминокислотам, и прежде всего - незаменимым. Следующий пункт на рассмотрении, это..
Строение белка
Мы уже знаем, что белок – это сложное высокомолекулярное органическое вещество, структурная организация которого может быть представлена 4 уровнями (структурами): первичной (1), вторичной (2), третичной (3) и четвертичной (4) (см. изображение).
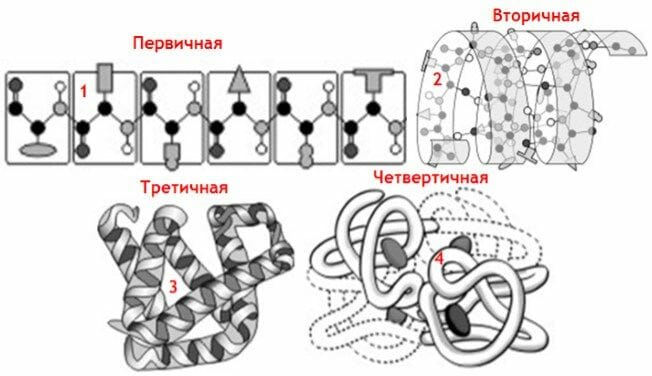
Техническую сторону уровней организации белка (что и как устроено с точки зрения элементов/связей),Вам знать не обязательно, а вот практической мы сейчас займемся.
Итак, некоторые белковые продукты усваиваются на раз-два, а некоторые перевариваются в течении длительного времени. От чего это зависит, спросите Вы? Конечно же от их строения. Например, молочные и яичные белки усваиваются хорошо из-за того, что они находятся в растворе в виде отдельных молекул, свернутых в клубки. Допустим, если молоко скисло и получился творог (т.е. казеин выпал в осадок) или мы варим яйца, происходит денатурация (изменение пространственной структуры белка, связанное с потерей им своих уровней организации).
Часть связей (в особенности сульфидные мостики) в результате этого процесса рвется, белковые молекулы в продуктах распрямляются, спутываются и организму уже становится сложнее усвоить эту измененную структуру белка. Однако стоит заметить, что в процессе варки мяса, его белки наоборот становятся легкоусвояемыми, хотя и теряют некоторую пищевую ценность.
Приведенная информация вовсе не побуждает Вас есть сырые яйца или не кипятить молоко (хотя магазинное по большей части – пастеризованное). Просто помните, если у Вас есть свой домик в деревне (или Вы просто уверены в качестве приобретенных продуктов), то можете их употреблять в первозданном виде, без какой-либо обработки.
Примечание:
Куриные яйца можно легко заменить на перепелиные и есть их сырыми, ибо перепелка не болеет сальмонеллезом, т.к. ее температура тела составляет 42 градуса.
Насчет мяса следует сказать, что его белковые волокна не предназначены для поедания (во как, ну-ка перестали его есть), они предназначены для того, чтобы вырабатывать силу, как бодибилдер. Именно из-за этого его волокна жесткие, они пронизаны поперечными связями и его трудно переварить. Процесс денатурации (в частности, варка мяса) несколько облегчает задачу нашему ЖКТ, разрушая определенные поперечные связи, однако чтобы его полностью усвоить, организму порой требуется от 3 до 6 часов.
Бонусом за все старания в переваривании мяса является креатин – природный источник, повышающий работоспособность мускулатуры и интенсивность тренировок. Что у нас на растительном фронте?
По большей части, основной источник растительных белков – это различные семена (бобы, горох, чечевица и т.п.). В них белок “упакован” достаточно плотно, и чтобы привести его в чувства надлежащее (для быстрого переваривания) состояние, необходимо изрядно потрудиться. Грибной белок также тяжел из-за своей волокнистой структуры и присутствия в его составе углеводных остатков. Соя – вот та золотая середина (и по биологической ценности, и по хорошей усвояемости), которая является наиболее предпочтительным растительным белком, однако стоит помнить, что и ее белок неполноценен и нужно комбинировать его с продуктами животного происхождения.
Теперь давайте посмотрим на продукты с достаточно высоким содержанием белка, дабы иметь представление, что необходимо включить в свой рацион для наращивания мышечной массы (см. таблицу).
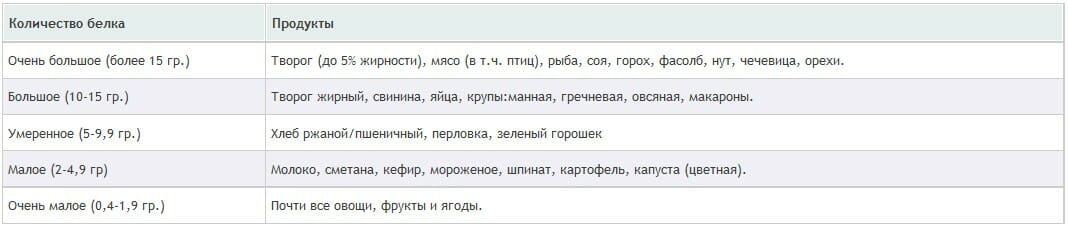
Собственно, исходя из приведенной таблицы, Вы уже можете составить свой рацион практически на весь день, главное помнить о принципах рационального питания и о том, какое количества белка Вам нужно употребить в течении суток. Давайте еще раз это закрепим на примере.
Для представителей мужского пола, которые только начали ходить в тренажерный зал, показатель суточного потребления белка на килограмм веса должен составлять от 1,5 до 2 гр, т.е. если Ваш вес 70 кг, то в день Вы должные съедать 105-140 гр чистого белка. Если Вы продвинутый атлет, тогда цифра потребления вырастет до 2,5 гр/кг, т.е. 170 гр (при том же весе) – это норма.
Потребляйте такое количество белка из разнообразных продуктов, т.е. не стоит “лупить” 7 раз в неделю одну куриную грудку или творог, варьируйте свою белковую продуктовую корзину, и тогда мышцы не заставят себя долго ждать!
Ну и напоследок разберем, какие существуют…
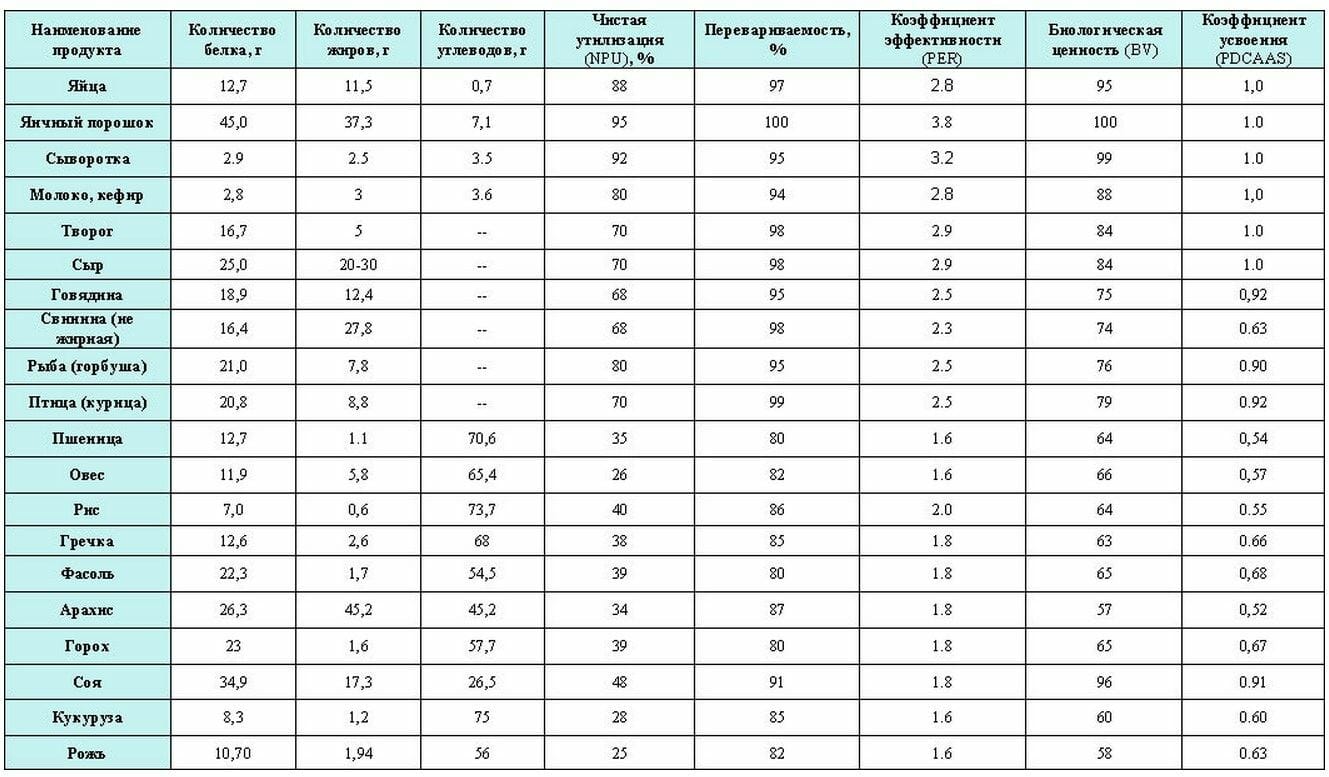
Критерии оценки качества белка
Мы уже упоминали про его биологическую ценность (BV). С точки зрения химии – это та доля азота (N), задерживающегося в организме от всего поступившего/всосавшегося азота. Измерение BV основано на том, что если в организме человека находится требуемое количество всех незаменимых аминокислот, то и задержка N – выше.
Помимо этого показателя существуют еще следующие:
- полный аминокислотный профиль
Белок должен быть сбалансирован по своему аминокислотному составу. Это значит, что белки пищи по соотношению незаменимых кислот, должны соответствовать белкам человека, чтобы не было процессов нарушения синтеза собственных белков и сдвига равновесия анаболизма-катаболизма мышц в сторону их распада;
- доступность аминокислот в белке
Чем больше в продуктах различных добавок, красителей и чем больше осуществляется тепловая обработка белков, тем ниже доступность отдельных аминокислот;
- перевариваемость – степень усвояемости белка
Отражает, насколько быстро или сколько времени прошло с момента, когда белок попал в желудок (и расщепился ферментами ЖКТ) и до последующего всасывания отдельных аминокислот через стенки кишечника;
- чистая утилизация белка
Показатель характеризует как степень задержки азота, так и количество перевариваемого белка;
- коэффициент эффективности белка
Специфический показатель, который определяется по воздействию конкретного белка на рост мускулатуры, т.е. прирост мышц пропорционален количеству потребленного белка;
- коэффициент усвоения белка по аминокислотному составу
Учитывает как химическую ценность (состав аминокислот), так и биологическую ценность (полноту переваривания) белков. Если коэффициент равен 1, значит продукт – самый полноценный источник протеина. Итак, теперь давайте ознакомимся с конкретными цифрами (да сколько можно :)) и оценим качество белков в конкретных продуктах питания (см. изображение).
Собственно на сим все, подведем некоторые итоги.
FAQ или ЧАВО надо усвоить?

Было бы просто непростительной ошибкой не подвести некоторый знаменатель всему тому, что тут было сказано (а сказано не мало). Поэтому запомните простые советы, которые позволят Вам лучше ориентироваться в вопросах включения в свой рацион такого ценного строителя мышц, фундаментального кирпичика как белок.
Всегда помните, что:
- Необходимо, чтобы в Вашем рационе преобладали белки преимущественного животного происхождения - до 80%, и только 20%, отдаем на откуп растительным;
- Сочетайте растительные и животные белки, например: картофель-соя, пшеница-яйца, рожь-молоко;
- Потребляйте необходимую Вам норму белка: 1,5-2 гр/кг веса тела – для новичков, для продвинутых бодибилдеров – до 2,5 гр;
- Заботьтесь о качестве потребляемого протеина, т.е. об источниках, откуда будете его получать;
- Не забывайте про незаменимые аминокислоты, которые организм не может самостоятельно синтезировать;
- Не обедняйте рацион за счет углеводов/жиров, не делайте перекосов по основным нутриентам (белкам, жирам, углеводам);
- Потребляйте витамины и их комплексы для полноценного усвоения белков (о них читайте в следующих статьях);
- Читайте проект “Азбука Бодибилдинга”!
Следуя этим простым советам (особенно последнему), Вы резко увеличите свои шансы на построение рельефных мышц.
Послесловие
Ну вот и подошла к концу наша очередная статья. Сегодня мы говорили про белок, его роль и место в рационе питания бодибилдера. Так же узнали все технические моменты, касающиеся его строения, состава и прочее. В следующий раз мы больше узнаем о практической стороне их применения, т.е. как максимально сохранить ценность белка, что такое протеин для качков и какие существуют мифы относительно протеинов в целом.
Так что далеко не уходим, подписываемся на статьи, читаем, анализируем и применяем информацию. Таки все, до связи!
Ах да, не забудьте посмотреть занятное видео и еще раз убедиться, что «жизнь – это способ существования белковых тел».
PS. вторая часть заметкиЧитайте также:
Это интересно:
ferrum-body.ru
Нуклеиновые кислоты - презентация онлайн
А) Мономерами белков являются… ;
Б) Всего в белках имеется … видов аминокислот Б) Основная связь между мономерами белка -… В) Вторичная структура белка в виде… В) Первичная структура белка в виде …;
Г) Четвертичная структура белка в виде…;
Г) Третичная структура белка в виде…;
Д) Восстановление природной структуры белка называется…;
Д) Разрушение природной структуры белка называется… На выполнение задания - 3 минуты На «4» 2.
Вместо точек проставьте соответствующие функции белков А) Ускоряя химические реакции в клетке, белки выполняют … функцию.
А) Ферменты выполняют… функцию Б) Белки-гормоны выполняют … функцию Б) Антитела выполняют … функцию.
В) Гемоглобин выполняет …функцию.
В) Белки в составе мышц, хрящей, волос и т.д.
выполняют … функцию.
Г) Сократительные белки выполняют … функцию Г) Белки клеточных мембран, улавливающие воздействия на них выполняют… функцию.
На выполнение задания – 5 минут5 На «5» 3.
Ответьте на 1 вопрос (на выбор) А) Чем можно объяснить огромное разнообразие белков в природе, несмотря на то, что в их состав входят одни и те же аминокислоты? А) Почему для человека опасно повышение температуры тела свыше 410? Б) Какую структуру могут иметь белки в составе мышц и почему? Б) Какую структуру могут иметь белки в составе сухожилий и почему? В) Чем сходны и чем отличаются простые белки от сложных? В) Какой структурой определяются все особенности строения белка и почему? На выполнение задания – 2 минуты6 ПРОВЕРКА ОТВЕТОВ: 1 вариант2 вариант 1.Вместо точек проставьте нужные слова: А)В состав белков входят элементы N,С,О,Н А) Мономерами белков являются аминокислоты Б) Всего в белках имеется20 видов аминокислот Б) Основная связь между мономерами белка - пептидная В) Вторичная структура белка в виде спирали В) Первичная структура белка в виде цепочки аминокислот Г) Четвертичная структура белка в виде нескольких связанных глобул Г) Третичная структура белка в виде глобулы Д) Восстановление природной структуры белка называется ренатурация Д) Разрушение природной структуры белка называется денатурация 2.
Какую функцию белков отражают примеры? А) Ускоряя химические реакции в клетке, белки выполняют каталитическую функцию.
А) Ферменты выполняют каталитическую функцию Б) Белки-гормоны выполняют регуляторную функцию Б) Антитела выполняют защитную функцию.
В) Гемоглобин эритроцитов выполняет транспортную функцию.
В) Белки в составе мышц, хрящей, волос и т.д.
выполняют строительную функцию.
Г) Сократительные белки выполняют двигательную функцию Г) Белки клеточных мембран, улавливающие воздействия на них выполняют сигнальную функцию.
• заполнять таблицы по тексту учебника
• сравнивать объекты - молекулы ДНК и РНК
• логически связывать строение, свойства и функции молекул нуклеиновых кислот ТЕМА УРОКА: НУКЛЕИНОВЫЕ КИСЛОТЫ ЦЕЛИ И ЗАДАЧИ УРОКА: УЗНАТЬ: НАУЧИТЬСЯ: РАЗВИВАТЬ УМЕНИЯ: Состав, структуру и функции молекул нуклеиновых кислот.
Решать задачи на применение принципа комплементарности8 НУКЛЕИНОВЫЕ КИСЛОТЫ МОНОМЕРЫ - НУКЛЕОТИДЫ ДНК – дезоксирибонуклеиновая кислота РНК рибонуклеиновая кислота Состав нуклеотида в ДНК Состав нуклеотида в РНК Азотистые основания: Аденин (А) Гуанин (Г) Цитозин (Ц) Урацил (У): Рибоза Остаток фосфорной кислоты Азотистые основания: Аденин (А) Гуанин (Г) Цитозин (Ц) Тимин (Т) Дезокси- рибоза Остаток фосфорной кислоты Информационная (матричная) РНК (и-РНК) Транспортная РНК (т-РНК) Рибосомная РНК (р-РНК)9 СТРУКТУРЫ ДНК И РНК Дж.Уотсон и Ф.Крик Открыли структуру ДНК в 1953г.10 СТРУКТУРЫ ДНК И РНК ДНК11 ДНК В СОСТАВЕ ХРОМОСОМ12 Выполнение задачи на комплементарность Комплементарность – это взаимное дополнение азотистых оснований в молекуле ДНК.
Задача : фрагмент цепи ДНК имеет последовательность нуклеотидов: Г Т Ц Т А Ц Г А Т Постройте по принципу комплементарности 2-ю цепочку ДНК.
РЕШЕНИЕ: 1-я цепь ДНК: Г-Т-Ц-Т-А-Ц-Г-А-Т.
Ц-А-Г-А-Т-Г-Ц-Т-А 2-я цепь ДНК: Значение комплементарности: Благодаря ей происходят реакции матричного синтез
ppt-online.org
строение и биологические функции молекулы белка
Здравствуйте, мои дорогие читатели. С вами я, Галина Баева, и сегодня мы поговорим о строении и функциях молекул белка.
Зачем он нужен, этот белок? Может, без него обойдемся?
Нет, не обойдемся. Бородатый основатель диалектического материализма Фридрих Энгельс сказал: жизнь – есть способ существования белковых тел. Иначе говоря, белок – это жизнь, нет белка – увы и ах. В норме белок составляет 50%, т.е. половину от сухой массы клетки, а от сухой массы тела человека они составляют от 45%.
Особенности строения белков позволяют им проявлять различные свойства, чем обусловлены их разнообразные биологические функции
Белки иначе называют протеинами, это одно и то же.
Чем занимаются белки в организме?

- Протеины являются теми кирпичиками, из которых сложен наш организм. Они являются структурными элементами клеточных мембран (липопротеины, гликопротеины), и внеклеточных структур. Коллаген образует сухожилия, он же отвечает за упругость кожи, кератин образует волосы и ногти.
- Протеины транспортируют необходимые элементы по организму. Гемоглобин переносит кислород от легких ко всем органам и тканям, а от них – уносит углекислый газ, белок альбумин переносит жирные кислоты, особые белки таскают холестерин. В составе клеточных мембран имеются белки, которые обеспечивают перенос некоторых веществ и ионов из клетки во внеклеточное пространство и обратно.
- Гормоны – особые вещества, регулирующие процессы обмена веществ – имеют белковую природу. Например, гормон инсулин загоняет сахар из плазмы крови в клетки
- Протеины защищают организма от чужеродных агентов. Гамма — глобулины обезвреживают микробов, интерфероны подавляют размножение вирусов. Фибрин останавливает кровотечения.
- Протеины обеспечивают сокращение двигательной мускулатуры и других сокращающихся тканей. Актин и миозин входят в состав мышц тела, тропонин, тропомиозин – мышц сердца.
- Протеины принимают сигналы из внешней среды и передают команды в клетку. Под воздействием факторов внешней среды сигнальные белки изменяют свою третичную структуру, что в свою очередь запускает цепь биохимических процессов. Так родопсин реагирует на свет, преобразуя световую энергию в электрическую, которая передается по нервным клеткам в головной мозг, где формируется зрительная картинка.
- Протеины являются ферментами – катализаторами, благодаря которым возможно протекание биохимических реакций при низких температурах (370С).
- Протеины – регуляторы включают и выключают гены клетки, тем самым подавляя либо активируя биохимические процессы.
- Протеины, как правило, не накапливаются в организме, за исключением альбумина яйца и казеина молока. Лишних белков в организме нет. Однако, они могут соединяться с другими веществами и микроэлементами, препятствуя их выведению из организма. Так ферритин образует комплекс с железом, высвобождающимся при распаде гемоглобина, и вновь включает его в биологические процессы.
- Протеины могут давать энергию. При распаде 1 г. белка выделяется 4 ккал (17,6 кДж). В качестве источника энергии белки используются при истощении других, нормативных источников – углеводов и жиров. Перефразируя Д.И.Менделеева, можно сказать, что топить белками, это все равно что топить ассигнациями, настолько они ценны для организма.
Что представляет собой молекула жизни?
Это длинная цепочка, т.е. полимер, состоящая из мономеров – аминокислот. Почему аминокислот? Потому что у каждой молекулы есть хвост органической кислоты C-O-OH и аминогруппа Nh3. В цепочке-полимере каждый мономер – аминокислота присоединяет свой кислотный остаток к аминогруппе другого мономера, получается прочная связь, именуемая пептидной.
Понятия белок и пептид близки, но не равнозначны. Обычно пептидами называют некоторую последовательность аминокислотных остатков. Выделяют олигопептиды – короткие цепочки в 10-15 аминокислот и полипептиды – длинные цепочки аминокислотных последовательностей. Белок – это полипептид, имеющий особую форму пространственной организации.

Нанизывая аминокислоты, как бусинки в ожерелке, формируется первичная структура белка, т.е. последовательность аминокислотных остатков.\
В пространстве белок существует не в виде вытянутой нитки, а завивается спиралью, т.е. формирует вторичную структуру.

Спиралька сворачивается в шарик – глобулу, это уже третичная структура белка.
Некоторые белки (не все) имеют четвертичную структуру, объединяя в своем составе несколько молекул, каждая со своей первичной, вторичной и третичной структурой.
Зачем это надо знать? Потому что переваривание и усвоение белка напрямую зависит от его структуры: чем плотнее упакован белок в составе пищевого продукта, тем тяжелее он поддается перевариванию, тем больше энергии надо затратить на его усвоение.
Распад связей в молекуле белка называется денатурацией. Денатурация может быть обратимой, когда белок восстанавливает структуру, и необратимой. Необратимой денатурации белки подвергаются в том числе при воздействии высокой температуры – для человека это свыше 420С, именно поэтому лихорадка опасна для жизни.
Мы подвергаем белки контролируемой денатурации в процессе приготовления пищи, когда варим мясо или рыбу, кипятим молоко, жарим или варим яйца, варим каши и печем хлеб. При мягком температурном воздействии, белки с распавшимися связями становятся более доступными для пищеварительных ферментов и лучше усваиваются организмом. При длительном и жестком температурном воздействии – жарке на углях, длительной варке – происходит вторичная денатурация белка с образованием трудноперевариваемых соединений.
Аминокислоты
Существует более двух сотен различных аминокислот, но в составе белков — полимеров постоянно встречаются лишь двадцать. Эти 20 «магических» аминокислот делятся на две неравные группы: заменимые, т.е. те, которые могут вырабатываться самим организмом, и незаменимые (эссенциальные), они организмом человека не вырабатываются, и мы должны в обязательном порядке получать их с пищей.
К заменимым аминокислотам относятся: Аланин, Аргинин, Аспаргин, Аспарагиновая кислота, Глицин, Глутамин, Глутаминовая кислота, Пролин, Серин, Тирозин, Цистин.
Незаменимые аминокислоты: Валин, Изолейцин, Лейцин, Лизин, Метионин, Трионин, Триптофан, Фенилаланин
Для детей незаменимыми аминокислотами являются Аргинин и Гистидин.
По аминокислотам будет отдельный пост.
Классификация белков

По содержанию аминокислот белки делятся на полноценные и неполноценные.
Полноценный белок содержит в своем составе все необходимые аминокислоты, а неполноценный белок, соответственно, каких-то аминокислот не содержит.
Для строительства всех белков организма важно не только наличие всех аминокислот, но и их пропорции в пищевом продукте. Пища, наиболее близкая по аминокислотному составу белкам тела человека, является оптимальной. Если какой-то одной аминокислоты не хватает, другие аминокислоты не могут использоваться организмом, более того, для того, чтобы возместить нехватку, начнут распадаться собственные белки, в первую очередь белки – ферменты, участвующие в процессах биосинтеза, и мышечные белки. В условиях недостатка той или иной незаменимой аминокислоты, другие аминокислоты оказываются избыточными, хотя этот избыток относительный. Распадающиеся мышечные белки образуют высокотоксичные продукты обмена и усиленно выводятся организмом, создавая отрицательных азотистый баланс. Человек начинает хиреть, хотя может искренне считать, что с питанием у него все в порядке.
По своему происхождению белки делятся на животные и растительные.
К животным белкам относятся белки яиц, молока и молочных продуктов, рыбы и морепродуктов, мясо животных и птиц.
К растительным белкам относятся белки зерновых, бобовых, орехов и грибов.
Продукты питания считаются белковыми, если они содержат не меньше 15% белка.
Все животные белки являются полноценными, т.е. содержат полный набор аминокислот. Большинство растительных белков являются неполноценными.
При недостаточном поступлении белка с пищей в организме развиваются дегенеративные процессы, связанные с невозможностью выполнять необходимые функции. В первую очередь страдает иммунитет. Человек становится предрасположен к вирусным и бактериальным инфекциям, болезни приобретают затяжной, хронический характер. Начинают выпадать волосы, кожа становится дряблой, морщинистой. Страдает волевая сфера, человека охватывает апатия, полное нежелание чем-либо заниматься, присоединяется депрессия. Уменьшается мышечная масса, замедляется обмен веществ. Начинаются проблемы с пищеварением, появляется т.н. «синдром раздраженного кишечника», когда прием пищи сопровождается метеоризмом, поносы сменяются запорами и наоборот. Угнетается детородная функция, у женщин прекращаются месячные. В тяжелых случаях начинаются структурные изменения в органах и тканях, видимое истощение. Белковое голодание детей приводит к умственной отсталости.
Тяжелое белковое голодание в наше время в цивилизованных странах, куда мы относим и нашу страну, если исключить заболевания, типа туберкулеза или онкологии, встречаются у людей, практикующих безумные голодные диеты в маниакальном стремлении похудеть.
Последнее сообщение касалось Анджелины Джоли, ее госпитализировали с весом 35 кг – такими застали советские освободители узников нацистских конц.лагерей. Вряд ли живые скелеты являли собой образцы красоты.
Однако недостаток белка – не такое уж редкое состояние, объясняющееся нездоровой структурой питания, сложившейся вследствие относительной дороговизны белковых продуктов. В стремлении сэкономить люди переходят на углеводно-жировую диету с потреблением неполноценного растительного белка. Свою лепту вносят полуфабрикаты, изготовленные из суррогатов и белковыми продуктами не являющимися. Так человек, покупающий готовые котлеты, колбасу, сосиски может искренне считать, что потребляет достаточно белка. Не заблуждайтесь.
В следующей статье вы узнаете, сколько и какого белка необходимо человеку, чтобы оставаться здоровым.
Оставляйте комментарии, делитесь информацией в социальных сетях. Галина Баева.
zaryad-zhizni.ru
Мышечные белки
Впервые А. Я. Данилевский (1881) разделил экстрагируемые из мышц белки на три класса: растворимые в воде, экстрагируемые 8 — 12% раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей. В настоящее время белки мышечной ткани делят на три основные группы: саркоплазматические белки, миофибриллярные белки, белки стромы. На долю первых приходится около 35%, вторых —45% и третьих-20% всего мышечного белка. Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки, входящие в состав саркоплазмы, принадлежат к числу протеинов, растворимых в солевых средах с низкой ионной силой.
К числу саркоплазматических белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обменов. Недавно была открыта группа саркоплазматических белков — парвальбумины, которые способны связывать ионы кальция.
К группе миофибриллярных белков относятся миозин, актин и актомиозин — белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
Миозин составляет 50-55% от сухой массы миофибрилл. Миозин обладает АТФазной активностью, т. е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи и несколько коротких легких цепей. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головку» молекулы), способную соединяться с актином. Эти головки выдаются из основного стержня молекулы.
Толстые нити (толстые миофиламенты) в саркомере получены путем соединения большого ппчисла определенным образом ориентированных в ппппппппппппппппппппппппппппппппппппространстве молекул миозина.
Актин, составляющий ~20% от сухой массы миофибрилл. Известны две формы актина: глобулярный (Г-актин) и фибриллярный (Ф-актин) актин. Молекула Г-актина состоит из одной полипептидной цепочки, в образовании которой принимают участие 374 аминокислотных остатка. Ф-актин является продуктом полимеризации Г-актина и имеет структуру двухцепочечной спирали.
Актомиозин образуется при соединении миозина с Ф-актином. Актомиозин, как обладает АТФазной активностью. Однако АТФазная активность актомиозина отличается от АТФазной активности миозина. Фермент актомиозин активируется ионами магния и ингибируется этилен-диаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня. На долю тропомиозина приходится около 4 — 7% всех белков миофибрилл.
Т
Структура тонкого филамента.
1 — актин; 2 — тропомиозин; 3 — тропонин С;
4 — тропонин
I; 5 — тропонин Тропонин — глобулярный белок, открытый С. Эбаси в 1963 г. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, Тн-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция.Белки стромы в поперечнополосатой мускулатуре представлены в основном коллагеном и эластином.
Небелковые азотистые экстрактивные вещества
В скелетных мышцах содержится ряд важных азотистых экстрактивных веществ: адениновые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатин-фосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др.
На долю креатина и креатинфосфата приходится до 60% небелкового азота мышц. Креатинфосфат и креатин относятся к тем азотистым экстрактивным веществам мышц, которые участвуют в химических процессах, связанных с мышечным сокращением.
К числу азотистых веществ мышечной ткани принадлежат и имидазолсодержащие дипептиды — карнозин и ансерин.
Карнозин и ансерин — специфические азотистые вещества скелетной мускулатуры позвоночных — увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Имидазолсодержащие дипептиды не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки.
Среди свободных аминокислот в мышцах наиболее высокую концентрацию имеет глутаминовая кислота (до 1,2 г/кг) и ее амид - глутамин (0,8-1,0 г/кг). В состав различных клеточных мембран мышечной ткани входит ряд фосфоглицеридов: фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др. Другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин — встречаются в мышечной ткани в небольшом количестве.
studfiles.net
Сократительные белки: функции, примеры
Белки (полипептиды, протеины) представляют собой высокомолекулярные вещества, в состав которых входят альфа-аминокислоты, соединенные пептидной связью. Состав протеинов определяется в живых организмах генетическим кодом. Как правило, при синтезе используется набор из 20 стандартных аминокислот. 
Классификация белков
Разделение протеинов осуществляется по разным признакам:
- Форме молекулы.
- Составу.
- Функциям.
По последнему критерию белки классифицируются:
- На структурные.
- Питательные и запасные.
- Транспортные.
- Сократительные.
Структурные белки
К ним относят эластин, коллаген, кератин, фиброин. Структурные полипептиды участвуют в процессе формирования мембран клеток. Они могут создавать в них каналы или осуществлять иные функции.
Питательные, запасные протеины
Питательным полипептидом является казеин. За счет него растущий организм обеспечивается кальцием, фосфором и аминокислотами.
Запасными являются белки семян культурных растений, яичный белок. Они потребляются на этапе развития зародышей. В человеческом организме, как и у животных, протеины не откладываются в запас. Их необходимо регулярно получать с пищей, иначе вероятно развитие дистрофии. 
Транспортные полипептиды
Классическим примером таких белков является гемоглобин. В крови обнаруживаются и другие полипептиды, участвующие в перемещении гормонов, липидов и других веществ.
В мембранах клетки находятся протеины, обладающие способностью транспортировать ионы, аминокислоты, глюкозу и прочие соединения через клеточную мембрану.
Сократительные белки
Функции этих полипептидов связаны с работой мышечных волокон. Кроме того, они обеспечивают движение ресничек и жгутиков у простейших. Сократительные белки выполняют функцию транспортировки органелл внутри клетки. За счет их наличия обеспечивается изменение клеточных форм.
Примерами сократительных белков являются миозин и актин. Стоит сказать, что эти полипептиды обнаруживаются не только в клетках мышечных волокон. Сократительные белки выполняют свои задачи практически во всех тканях животных.
Особенности
В клетках обнаруживается индивидуальный полипептид – тропомиозин. Сократительный мышечный белок миозин является его полимером. Он образует комплекс с актином.
Сократительные белки мышц не растворяются в воде.
Скорость синтеза полипептидов
Ее регулируют тиреоидные и стероидные гормоны. Проникая в клетку, они связываются со специфическими рецепторами. Образованный комплекс проникает в клеточное ядро и связывается с хроматином. За счет этого повышается скорость синтеза полипептидов на генном уровне. 
Активные гены обеспечивают усиление синтеза определенной РНК. Она выходит из ядра, направляется к рибосомам и активирует синтез новых структурных либо сократительных белков, ферментов или гормонов. В этом заключается анаболическое действие генов.
Между тем белковый синтез в клетках – процесс достаточно медленный. Он требует больших энергетических затрат и пластического материала. Соответственно, гормоны не в состоянии оперативно контролировать метаболизм. Ключевая их задача состоит в регуляции роста, дифференциации и развития клеток в организме.
Мышечное сокращение
Оно является ярким примером сократительной функции белков. В ходе исследований было установлено, что в основе сокращения мускулатуры лежит изменение физических свойств полипептида.
Сократительную функцию выполняет белок актомиозин, взаимодействующий с аденозинтрифосфорной кислотой. Эта связь сопровождается сокращением миофибрилл. Такое взаимодействие можно наблюдать вне организма.
К примеру, если на вымоченные в воде (мацерированные) волокна мышц, лишенные возбудимости, воздействовать раствором аденозинтрифосфата, начнется их резкое сокращение, аналогичное сокращению живой мускулатуры. Этот опыт имеет важнейшее практическое значение. Он доказывает тот факт, что для мышечного сокращения необходима химическая реакция сократительных белков с веществом, богатым энергией.
Действие витамина Е
С одной стороны, он является главным внутриклеточным антиоксидантом. Витамин Е обеспечивает защиту жиров и прочих легкоокисляемых соединений от окисления. Вместе с тем он выступает в качестве переносчика электронов и участвует в окислительно-восстановительных реакциях, которые связаны с запасанием высвобождаемой энергии. 
Дефицит витамина Е вызывает атрофию мышечной ткани: содержание сократительного белка миозина резко уменьшается, и его заменяет коллаген – инертный полипептид.
Специфика миозина
Он считается одним из ключевых сократительных белков. На его долю приходится порядка 55 % от общего содержания полипептидов в мышечной ткани.
Из миозина состоят филаменты (толстые нити) миофибрилл. В молекуле присутствует длинная фибриллярная часть, имеющая двуспиральную структуру, и головки (глобулярные структуры). В составе миозина выделяют 6 субъединиц: 2 тяжелые и 4 легкие цепи, находящиеся в глобулярной части.
В качестве основной задачи фибриллярного участка выступает способность формировать пучки филаментов миозина или толстые протофибриллы.
На головках находятся активный участок АТФ-азы и актинсвязывающий центр. За счет этого обеспечивается гидролиз АТФ и связь с актиновыми филаментами.
Разновидности
Подвидами актина и миозина считаются:
- Динеин жгутиков и ресничек простейших.
- Спектрин в мембранах эритроцитов.
- Нейростенин перисинаптических мембран.
К разновидностям актина и миозина можно также отнести полипептиды бактерий, ответственные за перемещение различных веществ в градиенте концентраций. Этот процесс называется также хемотаксисом. 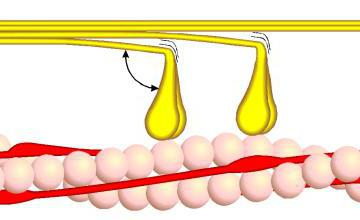
Роль аденозинтрифосфорной кислоты
Если поместить нити актомиозина в раствор кислоты, добавить ионы калия и магния, можно увидеть, что они укорачиваются. При этом наблюдается расщепление АТФ. Это явление свидетельствует о том, что распад аденозинтрифосфорной кислоты имеет определенную связь с изменением физико-химических свойств сократительного белка и, следовательно, с работой мышц. Впервые этот феномен был выявлен Сцент-Дьиордьи и Энгельгардтом.
Синтез и распад АТФ имеют важнейшее значение в процессе превращения химической энергии в механическую. При распаде гликогена, сопровождающегося выработкой молочной кислоты, как и при дефосфорилировании аденозинтрифосфорной и креатинфосфорной кислот, участие кислорода не требуется. Этим объясняется способность изолированной мышцы функционировать в анаэробных условиях.
В волокнах мускулатуры, утомленных при работе в анаэробной среде, накапливаются молочная кислота и продукты, образовавшиеся при распаде аденозинтрифосфорной и креатинфосфорной кислот. В результате исчерпываются запасы веществ, при расщеплении которых выделяется необходимая энергия. Если поместить утомленную мышцу в условия, содержащие кислород, она будет его потреблять. Некоторое количество молочной кислоты начнет окисляться. В результате образуются вода и углекислый газ. Высвобождающаяся энергия будет использоваться для ресинтеза креатинфосфорной, аденозинтрифосфорной кислот и гликогена из продуктов распада. За счет этого мышца снова приобретет способность работать. 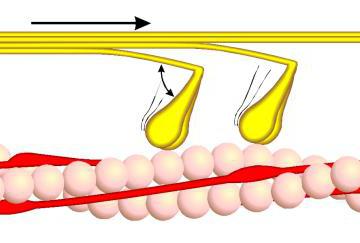
Скелетная мышца
Отдельные свойства полипептидов можно объяснить только на примере их функций, т. е. их вклада в сложную деятельность. Среди немногочисленных структур, в отношении которых была установлена корреляция между функциями белков и органа, особого внимания заслуживает скелетная мышца.
Ее клетка активируется за счет нервных импульсов (мембранно-направленных сигналов). В молекулярном плане сокращение основывается на циклическом формировании поперечных мостиков благодаря периодическим взаимодействиям между актином, миозином и Mg-АТР. Кальцийсвязывающие белки и ионы Са выступают в качестве посредников между эффекторами и нервными сигналами.
Посредничество ограничивает скорость ответа на импульсы "включение/выключение" и предотвращает самопроизвольные сокращения. Вместе с тем некоторые осцилляции (колебания) маховых мышечных волокон крылатых насекомых контролируют не ионы или аналогичные низкомолекулярные соединения, а непосредственно сократительные белки. За счет этого возможны очень быстрые сокращения, которые после активации протекают самостоятельно.
Жидкокристаллические свойства полипептидов
При укорочении мышечных волокон изменяется период решетки, образованной протофибриллами. При вхождении решетки из тонких нитей в структуру из толстых элементов тетрагональную симметрию сменяет гексагональная. Это явление можно считать полиморфным переходом в жидкокристаллической системе.
Особенности механохимических процессов
Они сводятся к трансформации химической энергии в механическую. АТФ-азная активность митохондриальных клеточных мембран имеют сходство с актом иозиновой системы скелетной мускулатуры. Общие черты отмечаются и в их механохимических свойствах: они сокращаются под влиянием АТФ. 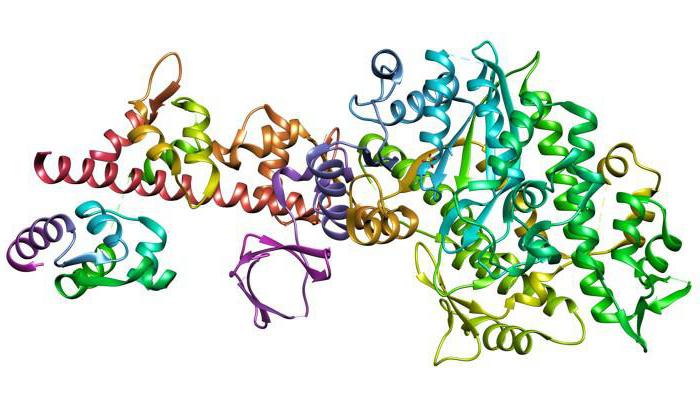
Следовательно, в мембранах митохондрий должен присутствовать сократительный белок. И он действительно там присутствует. Установлено, что сократительные полипептиды задействованы в митохондриальной механохимии. Однако выяснилось также, что значительную роль в процессах играет и фосфатидилинозитол (липид мембран).
Дополнительно
Молекула белка миозина не только способствует сокращению разных мышц, но и может участвовать в других внутриклеточных процессах. Речь, в частности, о перемещении органелл, прикреплении актиновых нитей к мембранам, формировании и функционировании цитоскелета и пр. Почти всегда молекула так или иначе взаимодействует с актином, являющимся вторым ключевым сократительным белком.
Было доказано, что молекулы актомиозина могут изменять длину под воздействием химической энергии, высвобождаемой при отщеплении от АТФ остатка фосфорной кислоты. Другими словами, именно этот процесс обуславливает сокращение мышц.
Система АТФ, таким образом, выступает как своего рода аккумулятор химической энергии. По мере надобности она превращается непосредственно в механическую при посредничестве актомиозина. При этом отсутствует промежуточный этап, характерный для процессов взаимодействия других элементов, - переход в тепловую энергию.
fb.ru
Что такое белки, какой у них состав, зачем они нужны? :: SYL.ru
О том, что такое белки, сейчас знает практически каждый из школьных уроков биологии. Они выполняют множество функций в клетке живого существа.
Что такое белки?
Это сложные органические соединения. Они состоят из аминокислот, которых всего существует 20, однако, соединив их в разной последовательности, можно получить миллионы разнообразных химических веществ.
Структура белков
Когда мы уже знаем, что такое белки, можно подробнее рассмотреть их строение. Существует первичная, вторичная, третичная и четвертичная структура такого рода веществ.
Первичная структура
Это цепь, в которой аминокислоты соединены в нужном порядке. Это чередование и определяет вид белка. Для каждого вещества данного класса оно индивидуально. От первичной структуры во многом зависят также физические и химические свойства того или иного белка.
Вторичная структура
Это пространственная форма, которую принимает полипептидная цепь за счет образования водородных связей между карбоксильными группами и имино-группами. Существует два наиболее распространенных ее типа: альфа-спираль и бета-структура, имеющая лентообразный вид. Первая формируется вследствие возникновения связей между молекулами одной и той же полипептидной цепи, вторая — между двумя или более расположенными параллельно цепями. Однако также возможно возникновение бета-структуры и в пределах одного полимера — в том случае, когда определенные его фрагменты повернуты на 180 градусов.
Третичная структура
Это чередование и расположение относительно друг друга в пространстве участков альфа-спирали, простых полипептидных цепей и бета-структур.
Четвертичная структура
Ее также существует два вида: глобулярная и фибриллярная. Такая структура формируется за счет электростатических взаимодействий и водородных связей. Глобулярная имеет форму небольшого клубка, а фибриллярная — нити. Примерами белков с четвертичной структурой первого типа могут служить альбумин, инсулин, иммуноглобулин и т. д.; фибриллярных — фиброин, кератин, коллаген и другие. Есть и еще более сложные по строению белки, к примеру, миозин, содержащийся в мышечных тканях, он имеет стержень фибриллярной формы, на котором расположены две глобулярные головки.
Химический состав белков
Аминокислотный состав белков может быть представлен двадцатью аминокислотами, которые комбинируются в различном порядке и количестве.
Это глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, лизин, аргинин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, фенилаланин, тирозин, триптофан, гистидин и пролин. Среди них есть незаменимые, то есть те, которые организм человека не в состоянии вырабатывать самостоятельно. Таких аминокислот насчитывается 8 для взрослых и еще 2 для детей: лейцин, изолейцин, валин, метионин, лизин, триптофан, фенилаланин, треонин, а также гистидин и аргинин.
Примеры белков с разной структурой
Ярким представителем глобулярных белков является альбумин. Его третичная структура состоит из альфа-спиралей, которые соединяются одиночными полипептидными цепочками.
Первичная же образуется такими аминокислотами, как аспаргиновая кислота, аланин, цистеин и глицин. Данный белок находится в плазме крови и выполняет функцию транспорта определенных веществ. Из фибриллярных можно выделить фиброин и коллаген. Третичная структура первого представляет собой вещество из бета-структур, которые соединены одиночными полипептидными цепочками. Сама цепь представляет собой чередование аланина, глицина, цистеина и серина. Данное химическое соединение является основным компонентом паутины и шелка, а также перьев птиц.
Что такое денатурация?
Это процесс разрушения сперва четвертичной, затем третичной и вторичной структур белка. Белок, с которым это случилось, уже не может выполнять свои функции и теряет основные физические и химические свойства. Такой процесс происходит в основном из-за воздействия высоких температур или агрессивных химических веществ. К примеру, при температуре выше сорока градусов Цельсия начинает денатурировать гемоглобин, переносящий кислород по крови организмов. Вот почему для человека опасно столь сильное повышение температуры.
Функции белков
Узнав о том, что такое белки, можно обратить внимание на роль этих веществ в жизни клетки и всего организма в целом. Они выполняют девять основных функций. Первая — пластическая. Они являются компонентами многих структур живого организма и служат в качестве строительного материала для клетки. Вторая — транспортная. Белки способны переносить вещества, примером веществ данного назначения являются альбумин, гемоглобин, а также разнообразные белки-транспортеры, находящиеся на плазматической мембране клетки, каждый из которых пропускает только определенное вещество в цитоплазму из окружающей среды. Третья функция — защитная. Ее выполняют иммуноглобулины, которые являются частью иммунной системы, и коллаген, являющийся основным компонентом кожного покрова. Также белки в организме человека и других организмов выполняют регуляторную функцию, так как существует некоторое количество гормонов, представленных такого рода веществами, к примеру, как инсулин. Еще одна роль, выполняемая этими химическими соединениями, — сигнальная. Данные вещества передают электрические импульсы из клетки в клетку. Шестая функция — двигательная. Яркими представителями белков, выполняющих ее, являются актин и миозин, которые способны сокращаться (они находятся в мышцах). Такие вещества могут также служить запасными, однако в таких целях они используются довольно редко, в основном это белки, которые есть в молоке. Они выполняют еще и каталитическую функцию — в природе есть ферменты белковой природы. И последняя функция— рецепторная. Существует группа белков, которые частично денатурируют под воздействием того или иного фактора, давая таким образом сигнал всей клетке, которая передает его дальше.
www.syl.ru
Белки мышечной ткани. Строение и функции
Среди белков мышечной ткани выделяют три основные группы: саркоплазматические белки, на долю которых приходится около 35 %, миофибриллярные белки, составляющие около 45 %, и белки стромы, количество которых достигает 20 %.
Саркоплазматические белки растворимы в воде и слабых солевых растворах. Основную массу их составляют белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого и липидного обменов, находящиеся в саркоплазме. К этой группе относится также белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин, и депонирует молекулярный кислород в мышцах. В последнее время открыта группа саркоплазматических белков парвальбуминов, которые способны связывать ионы кальция, однако их физиологическая роль остается невыясненной.
Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин, α- и β-актинины. Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных белков мышц, составляющий около 55 % общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка — около 470 000. В молекуле миозина различают длинную фибриллярную часть и глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет двуспиральную структуру (рис. 1).

Рис. 1. Схема строения молекулы миозина (а), миозинового пучка (б) и миозиновой толстой нити (в)
В составе молекулы выделяют шесть субъединиц: две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие цепи (молекулярная масса 1500-2700), расположенные в глобулярной части. Основной функцией фибриллярной части молекулы миозина является способность образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые протофибриллы. На головках молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами.
Молекула миозина содержит значительное количество глутаминовой аминокислоты и имеет большой отрицательный заряд, что усиливает связывание свободных ионов Са2+ и Мg2+. В присутствии ионов Са2+ повышается АТФ-азная активность миозина и скорость гидролиза АТФ согласно уравнению

Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, используется для изменения конформации белка миозина и генерации напряжения между толстыми и тонкими нитями миозина в сокращающейся мышце. Посредством ионов Мg2+ миозин способен присоединять молекулы АТФ и АДФ, а также взаимодействовать с молекулами актина, находящимися в составе тонких нитей миофибрилл.
Актин — второй сократительный белок мышц, который составляет основу тонких нитей (рис. 2). Известны две его формы — глобулярный G-актин и фибриллярный F-актин. Глобулярный актин — это шарообразный белок с молекулярной массой 42 000. На его долю приходится около 25 % общей массы мышечного белка. В присутствии Мg2+ актин подвергается нековалентной полимеризации с образованием нерастворимого филамента в виде спирали, получившего название F-актин. Обе формы актина не обладают ферментативной активностью. Каждая молекула G-актина способна связывать один ион Са2+, который играет важную роль в инициировании сокращения. Кроме того, молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с фибриллярным актином. Процесс полимеризации актина можно описать следующим уравнением:

F-актин активирует АТФ-азу миозина, что создает движущую силу процессу сокращения. Актин способен взаимодействовать с миозином, образуя актомиозиновый комплекс. Молярное соотношение актина и миозина в актомиозиновом комплексе — примерно 1:1. Нить F-актина может связывать большое число молекул миозина. Существенным свойством актомиозинового комплекса является диссоциация его в присутствии АТФ и Мg2+.

Рис. 2. Схема строения актиновой, или тонкой нити
В состав тонких нитей наряду с актином входят и другие минорные белки — тропомиозин, тропонины, актинины.
Тропомиозин (Тм) — это структурный белок актиновой нити, представляющий собой вытянутую в виде тяжа молекулу. Две его полипептидные цепи как бы обвивают актиновые нити. На концах каждой молекулы тропомиозина расположены белки тропониновой системы, наличие которой характерно только для поперечно-полосатых мышц.
Тропонин (Тн) является регуляторным белком актиновой нити. Он состоит из трех субъединиц — ТнТ, ТнI и ТнС. Тропонин Т(ТнТ) обеспечивает связывание этих белков с тропомиозином. Тропонин I (ТнI) блокирует (ингибирует) взаимодействие актина с миозином. Тропонин С (ТнС) — это Са2+-связывающий белок, структура и функции которого подобны широко распространенному в природе белку кальмодулину. Тропонин С, как и кальмодулин, связывает четыре иона Са2+ на молекулу белка и имеет молекулярную массу 17 000. В присутствии Са2+ изменяется конформация тропонина С, что приводит к изменению положения Тн по отношению к актину, в результате чего открывается центр взаимодействия актина с миозином.
Таким образом, тонкий филамент миофибриллы поперечно-полосатой мышцы состоит из F-актина, тропомиозина и трех тропониновых компонентов — ТнС, ТнI и ТнТ. Кроме этих белков, в мышечном сокращении участвует белок актинин. Обнаруживается он в зоне Z-линии, к которой крепятся концы F-актиновых молекул тонких нитей миофибрилл. Белки мышечной стромы в скелетной мышце представлены в основном коллагеном и эластином, которые входят в состав сарколеммы и Z-линий миофибрилл. Эти белки обладают эластичностью, большой упругостью, что имеет существенное значение для процесса сокращения и расслабления мышцы.
biofile.ru
- Инструкция калий оротат
- Фруктоза или сахар

- Фруктоза что это такое

- Упражнения для рук для девушек

- Витамины opti women инструкция по применению

- Мышцы на руках
- Как сделать стойку на руках

- Энергетик перед тренировкой своими руками

- Фрукты калорийность

- Упражнения для рук для женщин

- Энергетик своими руками перед тренировкой
